Карабанов И.А. «Флавоноиды в мире растений» — Минск: Ураджай, 1981
Светлой памяти замечательного советского ученого — селекционера, ботаника, микробиолога, биохимика, основоположника лечебного садоводства в нашей стране — профессора Леонида Ивановича Вигорова, чья деятельность всегда была для автора образцом служения науке, ПОСВЯЩАЕТСЯ
Фенолы, полифенолы, фенольные соединения… Все больше уделяют им внимания в последнее время научные журналы, газеты. Время от времени появляются новые факты об этих веществах, заинтересовавших не только ученых и практиков, но и широкий круг читателей.
Почти на каждом шагу, даже не подозревая, встречаются люди с наиболее обширным семейством природных растительных фенольных соединений — флавоноидами. И в самом деле: задумывался ли кто-нибудь о том, почему василек синий, а корнеплод столовой свеклы и стебель гречихи окрашены в красный цвет; чем обусловлен характерный аромат и цвет чайного напитка; почему одни яблоки на срезе темнеют, а другие — нет; почему ягоды одних сортов винограда красные, а других — бесцветные?
Оказывается, ко всему этому причастны в основном флавоноиды — антоцианы, лейкоантоцианы, катехины, флавонолы, флавоны и др. Они широко распространены в природе и совместно с другими веществами (в частности, каротиноидами) придают различным растительным органам самую разнообразную окраску. Некоторые флавоноиды нередко являются спутниками хорошо известного витамина С (аскорбиновой кислоты), проявляют Р-витаминное действие в организме человека и животных. За это свойство они получили название биологически активных веществ (биофлавоноидов). Некоторые из них за способность препятствовать окислению жиров нашли практическое применение в пищевой промышленности. Многие флаваноиды входят в состав лекарственных препаратов.
Растительные экстракты, содержащие более сложные по строению флавоноиды, которые издавна применяются в кожевенном производстве в качестве дубителей.
Словом, семейство этих соединений, считавшихся до недавнего времени отбросами в растительном организме, привлекли к себе пристальное внимание химиков, биологов, медиков, пищевиков и других специалистов. Только за 10 лет (966-1976) в нашей стране было проведено три представительных научных симпозиума по фенольным соединениям (Москва, 1966; Алма-Ата, 1971; Тбилиси, 1976). Флавоноидам плодово-ягодных растений должное внимание уделялось на Всесоюзных семинарах по биологически активным (лечебным) веществам плодов и ягод (Свердловск, 1960, 1963, 1966; Мичуринск, 1970; Москва, 1975). Первые три из них были организованы лично Леонидом Ивановичем Вигоровым, создателем и руководителем первой в стране лаборатории биологически активных веществ плодов и ягод.
В изучение флавоноидов, оказавшихся весьма распространенными в мире растений, важный вклад внесли отечественные ученые В. И. Палладии, А. И. Опарин, A. Л. Курсанов, М. Н. Запрометов, С. В. Дурмишидзе, М. А. Бокучава, К. М. Джемухадзе, В. Г. Минаева, Л. И. Вигоров, А. П. Волынец, У. В. Маргна, Л. П. Сарапуу, В. И. Литвиненко, Л. К. Клышев, В. А. Бандюкова, а также ряд зарубежных авторов — А. Сцент-Дьердьи (ВНР); Р. Робинсон, Дж. Харборн, Р. Томсон (Англия); Г. Сигелман, Е. Робертс (США); П. Риберо-Гайон (Франция); А. Нейш (Канада); Г. Гризебах, К. Фройденберг (ФРГ); В. Хиллис (Австралия); П. Каррер (Швейцария) и другие.
Поставив перед собой задачу популярно изложить основные сведения о некоторых группах флавоноидов, получивших в последнее время признание как биологически активные вещества, их образовании в мире растений, практическом значении для человека, автор не претендовал при этом на полное и всестороннее освещение проблемы, что в рамках сравнительно небольшого научно-популярного издания было бы непосильным трудом. Задача автора более скромная — рассказать широкой аудитории читателей о достижениях и перспективах в изучении и практическом использовании природных растительных веществ, проявляющих биологически активное действие на организм человека и животных, помочь по-иному взглянуть на окружающий мир растений, окинуть его взором не только с потребительских позиций, но и еще раз призвать беречь и приумножать богатства природы.
Автор искренне благодарен и признателен доктору биологических наук А. П. Волынцу (Институт экспериментальной ботаники имени В. Ф. Купревича АН БССР), тщательно прочитавшему рукопись книги и сделавшему ряд существенных замечаний, которые позволили улучшить содержание всех ее разделов.
Что такое «флавоноиды»?
Столетья таинства полны,
И не исчезнет жизнь, покуда
Есть ощущенье новизны,
И удивления, и чуда.
Расул Гамзатов
Ядовитый родоначальник неядовитых веществ. — Непременные спутники других «жильцов» растительной клетки. — Невидимки среди множества цветов и оттенков. — Две дороги ведут к одной цели. — Какой соперник сильнее? — Главное достоинство флавоноидов.
Бензол… Подвижная бесцветная жидкость со своеобразным запахом… Она известна каждому школьнику, изучающему химию. Попадая на кожу, она вызывает сильное раздражение, а ее пары нарушают нормальную функцию кроветворных органов, поражают центральную нервную систему.
Молекула бензола имеет циклическое строение. Она состоит из шести атомов углерода и шести атомов водорода. При замещении одного водородного атома группой ОН получается новое вещество — фенол, или карболовая кислота:
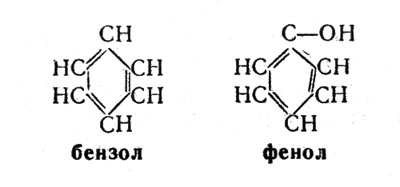
Фенол, или карболовая кислота
Полупрозрачные кристаллы фенола, розовеющие при хранении и обладающие резким запахом, хорошо известны также из школьного курса химии. «Будьте осторожны при обращении с фенолом», — предупреждает ребят каждый раз учитель химии. Фенол действительно оказывает губительное действие на организм человека — предельно допустимое его содержание в окружающей среде составляет всего лишь 0,005 мг в расчете на 1 л воздуха.
И бензол, и происходящий от него фенол, таким образом, являются сильными ядами. Они не относятся к природным веществам, а получены в лабораторных условиях. Не встречаясь в растительных клетках, бензол тем не менее явился родоначальником большой группы совершенно безвредных природных соединений — так называемых растительных фенолов (полифенолов). Они названы полифенолами (от греч. «поли» — много) потому, что молекулы их состоят не из одной, как у обычного фенола, а из большего числа фенольных групп. Напомним, что фенольная группа представляет собой не что иное, как шестичленное бензольное кольцо с боковой группой ОН. Поэтому полифенолами называются сложные органические вещества, в состав молекул которых входит несколько бензольных колец.
Профессор М. Н. Запрометов, занимающийся изучением полифенолов свыше четверти века, указывает, что их число в настоящее время достигло двух тысяч.
Среди этого огромного количества полифенольных соединений выделяются флавоноиды — наиболее сложные по химическому строению вещества. Каждая молекула флавоноидов представляет собой два циклических бензольных кольца, соединенных 3-углеродной цепочкой. Обозначаются они буквами А и Б. Большинство флавоноидов имеет структуру молекул, получившую название флавана (рис. 1).
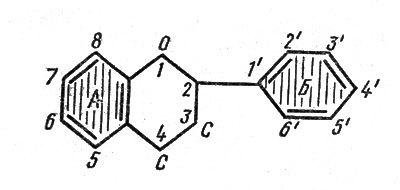
Рис. 1. Общая схема строения молекулы флавоноидов: А, Б — основное и боковые бензольные кольца
Термин «флавоноиды» по отношению к веществам с таким строением молекул был впервые введен в обиход английскими учеными Т. Гейссманом и Е. Гинрейнером еще в 1952 году.
Флавоноиды образуются всеми растительными организмами: в большей мере — цветковыми растениями, в меньшей — мхами, хвощами, папоротниками. В растительных клетках, этих мельчайших структурных единицах всех живых организмов, флавоноиды могут находиться как в свободном, так и в связанном состоянии. Связаны они чаще всего с сахарами (глюкоза, рамноза, ксилоза, арабиноза и др.) и называются гликозидами (от греческого «гликис» — сладкий) (рис. 2). Свободные флавоноиды называются агликонами, т. е. лишенными сахара (от греческих «а» — частица отрицания и «гликис»). Если с агликоном связан сахар глюкоза, то такой гликозид называется глюкозидом.
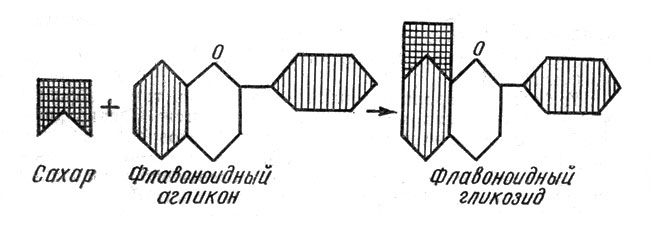
Рис. 2. Схема образования гликозидов путем присоединения сахара к молекуле флавоноидного агликона
С сахарами агликоны связываются или через атом кислорода (О-гликозиды), или же через атом углерода (С-гликозиды). Однако наличием только названных гликозидов не исчерпывается все богатство и разнообразие флавоноидов. Оно обусловливается еще и присутствием других веществ, присоединенных к агликону, и типом химической связи, и местом присоединения. Основная группа связанных флавоноидов — это О-гликозиды. В зависимости от количества входящих в их молекулы сахаров и порядка их присоединения эта группа подразделяется в свою очередь еще на несколько подгрупп.
Как правило, местом накопления связанных флавоноидов являются те растительные ткани и органы, которые отличаются наиболее высоким уровнем обмена веществ. С чем это связано? Дело в том, что взаимодействие агликонов с сахарами имеет важное значение в жизни растительного организма. Ведь гликозиды очень хорошо растворимы в воде и клеточном соке, обильно заполняющих вакуоли взрослых клеток. Благодаря этому они обладают более высокой подвижностью по сравнению с агликонами, активнее их вступают в различные биохимические процессы. В ряде случаев они «охотно» отдают свой сахар на различные нужды клетки. Словом, гликозиды нужнее всего там, где оживленнее протекают важнейшие жизненные процессы растительного организма.
Свободные флавоноиды (агликоны) чаще всего обнаруживаются в органах и тканях накопления — семенах, сердцевине деревьев, ягодах и др. В целом все семейство флавоноидов подразделяется в свою очередь на ряд групп: катехины, антоцианы, лейкоантоцианы, флавонолы, флавононолы, флавоны, изофлавоны, флавононы, халконы, дигидрохалконы, ауроны. Различия в свойствах этих групп обусловлены во многом степенью окисленности или восстановленности трехуглеродной цепочки, связывающей кольца А и Б их молекул. Вот как выглядит, например, эта цепочка в ряду «катехины — флавонолы» (рис. 3).
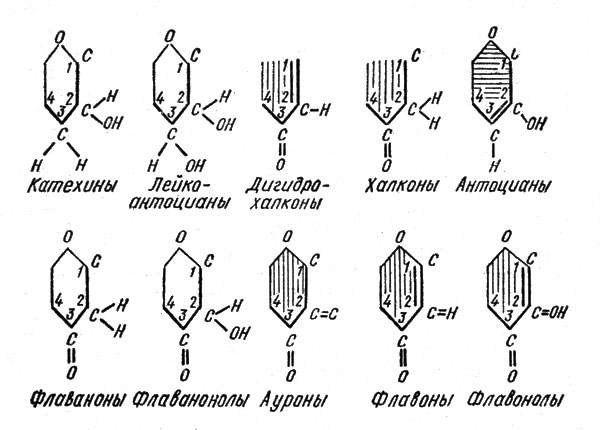
Рис. 3. Схема строения трехуглеродной цепочки, связывающей кольца А и Б, в молекулах различных групп флавоноидов
Как видим, наиболее окисленными в этом ряду являются флавонолы, наиболее восстановленными — катехины. Флавоны и флавонолы (от латинского «флавус» — желтый), а также дигидрохалконы, халконы и ауроны имеют желтую окраску, антоцианы окрашены в красный, синий, фиолетовый цвета или же в различные их оттенки. Все остальные флавоноиды бесцветны. Эти различия в окраске подчеркнуты на рис. 3 соответствующим цветом трехуглеродной цепочки.
Где же локализованы флавоноиды в пределах клетки, в какой части ее они обнаруживаются?
Обычно флавоноиды растворены в клеточном соке вакуолей, реже их можно найти в стенках клеток. Попытки обнаружить ферменты, принимающие участие в формировании молекул этих веществ в пластидах (мельчайших клеточных образованиях, рассеянных в цитоплазме), не удавались. Однако недавно в хлоропластах (клеточных пластидах, где совершается процесс фотосинтеза) найдены многие флавоноидные агликоны и некоторые ферменты, в связи с чем хлоропласт считается сейчас первичным местом образования простейших флавоноидов. В последнее время установлено присутствие в хлоропластах разнообразных флавоноидных гликозидов и эфиров. На примере люпина, льна и гороха А. П. Волынец и Р. А. Прохорчик (1974, 1978) показали, что в хлоропластах обнаруживаются все те флавоноиды, что и в целых листьях, причем по составу агликонов они часто превосходят своих листовых «собратьев».
Как же образуются флавоноиды в растительных клетках и тканях?
Вопрос этот издавна занимал умы ученых-биологов и долгое время они искали вещество — основной предшественник, из которого формируются кольца А и Б сложной молекулы флавоноидов. Эту проблему тридцать лет тому назад решила группа американских биохимиков во главе с Б. Девисом. Они выяснили, что предшественником одного из колец молекулы флавоноидов — кольца Б — является шикимовая кислота, выделенная впервые немецким ученым Й. Эйкманом из плодов аниса еще в 1885 году. Одновременно австралийские химики А. Барч, Р. Месси-Уэстропп и К. Мойс подтвердили предположение французского ученого Ж. Колли о том, что циклические соединения могут образовываться из уксусной кислоты. Они доказали на примере грибка пеницилла, что уксусная кислота является предшественником кольца А в молекуле флавоноидов. Так были установлены принципиальные пути образования флавоноидов, которые в дальнейшем получили название соответственно шикиматного (от шикимовой кислоты) и ацетатно-малонатного (от уксусной и малоновой кислот). Выяснению детального механизма образования флавоноидов в растениях способствовали исследования М. Н. Запрометова (СССР) и Г. Гризебаха (ФРГ).
Биосинтезу флавоноидов (рис. 4) в растениях как бы противостоит образование белка — основного носителя жизни. Выходит, флавоноиды — извечные соперники белка в ущерб жизненным функциям клеток?

Рис. 4. Схема образования флавоноидов в растениях (по М. Н. Запрометову с некоторыми видоизменениями). Слева — ацетатно-малонатный, справа — шикиматный путь формирования молекул флавоноидов
Действительно, как выяснилось, эти вещества соперничают с белком за использование аминокислоты фенилаланина (в ряде случаев — также и тирозина) для построения своих молекул. Однако соперничество это протекает не в ущерб жизненным процессам растительных организмов, а представляет собой пример реализации одного из альтернативных (запасных) путей в осуществлении нормальных функций клетки. Немецкий ученый М. Ленк в 1967 г. обратил внимание на тот факт, что аминокислоты фенилаланин и тирозин могут направлять течение внутренних процессов в клетках то в сторону образования белка, то — фенольных соединений. В настоящее время этот аспект образования флавоноидов и их биологического значения успешно изучается группой советских ученых во главе с профессором У. В. Маргна (Эстонская ССР). По их мнению, между белками и флавоноидами существует обратная взаимосвязь: если усиленно формируются молекулы белковых веществ, то ослабляется биосинтез флавоноидов и наоборот. Например, в условиях обильного азотного питания растений естественная антоциановая окраска их заметно ослабевает — растения переключают использование азотистых веществ на формирование белковых молекул.
Изучая накопление флавоноидов в зеленой массе кормовых растений на заливных лугах в пойме рек Сож (в окрестности г. Гомеля) и Ипуть (Гомельская и Брянская обл.), мы обратили внимание на следующее обстоятельство. Большинство кормовых злаков, содержащих обычно меньше белка по сравнению с бобовыми растениями, накапливает в зеленой массе 75-316 мг флавоноидов на каждые 100 г сухого вещества, в то время как бобовые (клевер, мышиный горошек), cклонные к накоплению белка, содержат только 29-36 мг флавоноидов в 100 г воздушно-сухой массы.
И еще об одном аспекте биологического значения флавоноидов. Накапливаются они в растительных тканях нередко в значительных количествах. У. В. Маргна отмечает, что для выполнения многих хорошо известных на сегодняшний день функций (регуляция ростовых процессов, развитие иммунитета, участие в биологическом окислении веществ и др.) «…необходимо, как правило, наличие только каталитических (т. е. незначительных. — И. К.) количеств флавоноидов в клетках, что в сотни и тысячи раз меньше обычного содержания флавоноидных производных в органах растений». Естествен вопрос: какой же смысл в накоплении огромного количества флавоноидов в растительных клетках?
Окончательного ответа на него пока еще нет, но ключом к его решению во многом служит деятельность фермента, который называется фенилаланин-аммиаклиаза (ФАЛ). Еще в 60-х годах нашего века канадские биохимики Г. Тауэре, М. Юнг и А. Нейш обратили внимание на широчайшее распространение этого фермента в растительных клетках. Исследования последнего времени показали, что возрастание активности ФАЛ часто сопровождается повышением содержания флавоноидов. На свету этот процесс протекает активнее, чем в темноте.
Какова же связь между деятельностью ФАЛ и накоплением флавоноидов? Этот фермент ускоряет отщепление аминогруппы NH2 от молекул аминокислоты фенилаланина, т. е. осуществляет распад, разрушение (так называемое «прямое дезаминирование») молекул этой незаменимой для организмов аминокислоты*. В результате такой «работы» фермента образуется вещество с совершенно новыми свойствами — коричная кислота (рис. 5).
* (Аналогичное действие с аминокислотой тирозином производит другой фермент — тирозин-аммиаклиаза (ТАЛ). )
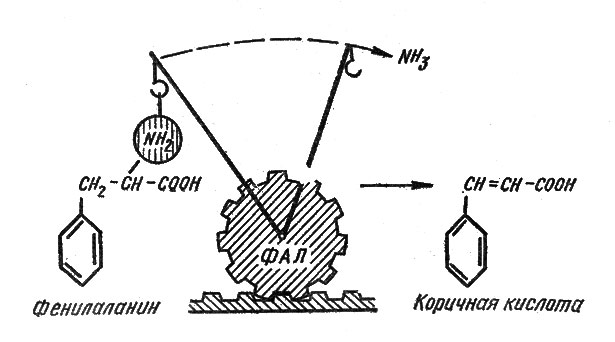
Рис. 5. Схема превращения аминокислоты фенилаланина в коричную кислоту под действием фермента фенилаланин-аммиаклиазы (ФАЛ)
Образовавшаяся коричная кислота не является фенольным соединением, так как не содержит обязательной для всех фенолов группы ОН в циклической части молекулы. Но это вещество дает начало в растительных клетках целому ряду фенольных соединений, получивших название оксикоричных кислот (от группы ОН, называемой иначе оксигруппой): паракумаровой (оксикоричной), кофейной, феруловой, синаповой. В свободном виде коричные кислоты более активны, поэтому нетрудно представить себе, что накопление их в клетках было бы в какой-то мере опасным для растительного организма. Эти кислоты являются непосредственными предшественниками флавоноидов.
Профессор У. В. Маргна (1972) считает, что включение коричных кислот в состав молекул флавоноидов — это не только способ их нейтрализации, но и общебиологический механизм, обеспечивающий возвращение продуктов распада белковых веществ (а фенилаланин является необходимой составной частью белковых молекул) в общий круговорот веществ растительного организма. Биологический смысл накопления флавоноидов в растительных клетках, по мнению И. В. Маргна, состоит в «умении» растений экономно распоряжаться углеродом своих органических соединений. Ключевое место в этом деле принадлежит незаменимой аминокислоте фенилаланину, «запасы» которой в клетках всегда меньше двух основных ее «потребителей» — биосинтеза флавоноидов и биосинтеза белка.
На первом месте у растений, конечно же, стоит проблема белка, поскольку он является носителем жизни. Но вот наступает момент, когда все нуждающиеся клетки обеспечены белком, а исходный «материал» — фенилаланин — израсходован не полностью. В процессе длительного развития растительные клетки выработали в себе способность «терпеливого ожидания» этого момента. Соответствующие ферменты, под контролем и при участии которых осуществляется формирование молекул флавоноидов, сохраняют обычно повышенную стойкость по сравнению с ферментами белкового синтеза. Они практически в любой момент находятся в «состоянии готовности» использовать фенилаланин, оказавшийся излишним для белковых нужд. Заметим, что такое «вынужденное» использование фенилаланина для образования флавоноидов отмечено при внедрении в растительный организм инфекции, при обработке растений гербицидами и в некоторых других случаях. Словом, путь формирования флавоноидных молекул в клетках всегда «оказывается кстати», стоит только растению попасть в нестандартную жизненную ситуацию.
Некоторые ученые (А. Нейш в Канаде, Г. Гризебах в ФРГ и др.) отмечают, что фенилаланин занимает ключевую позицию в биосинтезе не только флавоноидов, но и ряда других близкородственных полифенолов. М. Я. Оттер и У. В. Маргна (1975) обнаружили, например, синхронность накопления в проростках гречихи под влиянием фенилаланина как флавоноидов, так и хлорогеновой кислоты — фенольного вещества, выполняющего (в комплексе с некоторыми другими соединениями, например, фитоалексинами) роль защитного механизма в клетках от возбудителей заболеваний.
Другими словами, формирование молекул флавоноидов, хлорогеновой кислоты и других полифенолов рассматривается как наличие и проявление различных возможных путей в одном и том же процессе — быстром использовании свободных оксикоричных кислот, образующихся при распаде молекул фенилаланина под действием фермента ФАЛ. Характерно, что этот фермент «заявляет» о своем существовании на самых ранних этапах развития растительных организмов. Так, по наблюдениям М. Н. Запрометова и С. В. Шипиловой (1972), при проращивании семян кукурузы ФАЛ «дает о себе знать» уже на второй день появления проростков. Ее активность нарастает до 4-5-го дня, одновременно накапливаются флавоноиды, а также другие фенольные соединения. Скорость накопления и состав их значительно выше на свету, чем в темноте.
Следует заметить, что роль фермента ФАЛ, по-видимому, гораздо шире, чем только регуляция взаимоотношений между образованием флавоноидов и белковых веществ. В некоторых случаях, например, на обнаруживается повышенная активность этого фермента в местах значительного накопления фенольных соединений, или же наоборот — при высокой активности ФАЛ не всегда удается найти достаточно много фенолов. Так, в одной из своих работ С. В. Шипилова и М. Н. Запрометов (1977) отмечают, что в корнях молодых проростков чайного растения при достаточно высокой активности этого фермента катехины (наиболее характерные флавоноиды чая) или вообще отсутствуют, или же содержатся в незначительном количестве.
Где же используются в таком случае продукты распада аминокислоты фенилаланина, которую как бы «опекает» фермент ФАЛ? Они расходуются на формирование молекул лигнина — вещества, пропитывающего стенки растущих клеток, а также на образование других жизненно важных соединений.
Много общих свойств имеют флавоноиды растительных клеток. Но наиболее важным достоинством многих из них является способность проявлять биологически активное действие на организм человека, сходное с действием витамина Р. Заключается оно в предохранении кровеносных капилляров от ломкости и предотвращении подкожных кровоизлияний. За это свойство соответствующие флавоноиды получили название Р-активных веществ, т. е. веществ, проявляющих Р-витаминное действие. Л. И. Вигоров (1969, 1976) указывал, что необходимо различать профилактическую и лечебную потребность организма человека в Р-активных веществах. Для предупреждения хрупкости и проницаемости кровеносных капилляров следует, по мнению автора, принимать не менее чем 100-200 мг Р-активных флавоноидов в сутки. Если же из-за длительного недостатка этих веществ в организме произошли серьезные нарушения кровеносных сосудов, то дозу полифенолов следует увеличить до 1-2 г.
Где же их взять?
Главным источником Р-активных флавоноидов для человека являются фрукты и ягоды. В книге «Сад лечебных культур» (1976), увидевшей свет уже после кончины автора, Леонид Иванович Вигоров, заглядывая вперед с позиций сегодняшнего дня, писал: «И садовод далекого будущего с удивлением вспомнит о тех непонятных для него временах, когда о ценности плодов и ягод судили лишь по их вкусу, размеру и аромату, не считаясь с их действительным значением для охраны здоровья и увеличения длительности жизни человека».
В настоящее время установлено Р-витаминное действие на организм человека и животных антоцианов, лейкоантоцианов, катехинов, флавонов и флавонолов. Каждая из этих групп биологически активных флавоноидов (биофлавоноидов) имеет свои особенности. Об этих группах флавоноидов наш дальнейший рассказ.
Антоцианы украшают природу
Красота — благой природы
Дар счастливейший и сила;
Почитают все народы
В ней всё то, что сердцу мило.
Иван Гундулич
Синий василек и красные тюльпаны. — Близкое родство у дальних родственников. — Шесть природных красителей и бесконечное число красок. — Упорядоченный беспорядок. — Какая черника быстрее созревает? — Свет — наш батюшка родимый. — Один в двух лицах. — Защитники растений и человека. — Плодовая аптека.
Что в природе может быть прекраснее, чем цветущее растение? Все свои внутренние ресурсы мобилизует оно, чтобы точно в срок образовать бутоны и сформировать цветки.
Сорняком во ржи считается василек, но кто пройдет мимо, не обратив внимания на его ярко-синие лепесточки? А алые маки, гвоздики, розы? Стройные ряды тюльпанов с плотными красными головками под дуновением легкого ласкового ветерка переливаются как маленькие знамёна.
Всеми оттенками радуги играют цветущие петуния, ипомея, сальвия, фиалка, благоухая ароматом утренней свежести. Откуда берется эта естественная красота, ласкающая взор игрой своих цветов и оттенков? Нежные лепесточки цветков, имеющие окраску от сине-фиолетовой до красной со всевозможными нюансами, обязаны своим великолепием группе флавоноидов, которая получила название антоцианов (от греческих «антос» — цветок, «кианос» — синий).
Эти красящие вещества делают нарядными созревшие гроздья черной смородины и винограда, плоды сливы и вишни, сочные ягоды земляники и малины. Антоцианам обязаны своей окраской созревающие черника и голубика. Клеточный сок столовой свеклы от обилия антоцианов приобретает кроваво-красный цвет, по мере образования антоцианов краснеют многие сорта яблок.
Только ли в цветках и плодах «поселяются» эти природные красители? Оказывается, нет. К осени они накапливаются в листьях, изменяя (совместно с каротиноидами) зеленый наряд природы на красно-желтый. Хотите убедиться в этом — пойдите осенью в парк, где растут клены, платаны, березы… Листья некоторых видов растений (например, барбариса, колеуса) имеют постоянные красные тона от присутствия антоцианов. Словом, широко расселились эти пигменты в растительном мире, создав в природе своеобразную гармонию красок. Без антоцианов трудно даже представить себе мир растений.
Эти самые примечательные флавоноиды нередко называют антоцианинами. Такое название им дал еще в 1835 г. немецкий ученый Л. Маркварт. Необычайно красивая и разнообразная гамма расцветки антоцианов издавна привлекала внимание естествоиспытателей, пытавшихся объяснить причину такой природной красоты, выделить из лепестков эти красящие вещества, которые, как было замечено, обладали способностью при определенных условиях изменять свой цвет.
Известный английский химик Роберт Бойль еще в 1664 г. сообщил о результатах своих опытов с цветками василька. Он впервые обнаружил, что под действием кислот синий цвет лепестков этого растения изменялся на красный, под действием же щелочи лепестки зеленели. С тех пор делались многократные попытки объяснить различные оттенки в окраске антоцианов неодинаковой кислотностью клеточного сока и подтвердить такое объяснение опытным путем.
В 1913-1915 гг. немецкие биохимики Р. Вильштеттер и А. Штоль опубликовали серию работ, проливших свет на вопрос о сущности природной окраски антоцианов. Из цветков различных растений они выделили индивидуальные пигменты и описали их химическое строение. Оказалось, что антоцианы в клетках находятся преимущественно в виде гликозидов. Их агликоны, получившие название антоцианидинов, связаны преимущественно с сахарами глюкозой, галактозой, рамнозой. Каждый антоцианидин имеет свой цвет. Смешение цветов различных антоцианидинов и дает такое разнообразие природной окраски — от красной до фиолетовой. Даже один и тот же антоцианидин в зависимости от сдвига в величине кислотности клеточного сока может приобретать различные оттенки.
Сколько же известно в настоящее время различных антоцианидинов? Не так уж и много — основных их всего шесть (рис. 6). Отличаются они друг от друга по цвету, а также по неодинаковому расположению и количеству групп ОН (гидроксильных) и СН3 (метильных) в молекуле, т. е. отличия их состоят, как говорят биохимики, в различной степени гидроксилирования и метилирования молекул.
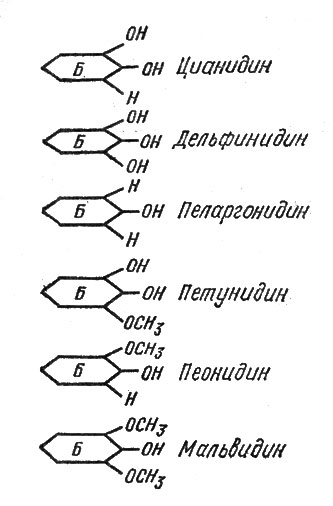
Рис. 6. Отличия различных антоцианидинов по боковому кольцу Б
Названия антоцианидинов соответствуют названиям растений, из которых они были получены в кристаллическом виде. Например, синий пигмент лепестков василька — цианидин, на получение 2,5 г которого понадобилось затратить 1 кг сухих лепестков, обязан своим названием этому растению (василек по-латыни — «центауреа цианус»).
Ало-красные цветки пеларгонии, голубовато-красные — пеонии, фиолетово-голубые — дельфиниума и петунии дали соответственно названия пеларгонидину, пеонидину, дельфинидину, петунидину. В соединении с сахарами они дают начало соответствующим антоцианам — пеларгонину, пеонину, дельфинину и т. д.
Наиболее распространены в растительном мире так называемые неметилированные антоцианидины, т. е. не содержащие в боковом кольце своих молекул (кольце Б) группу СН3. Первое место в этом отношении занимает цианидин, второе — дельфинидин, третье — пеларгонидин. Заметим, что порознь антоцианы в природных условиях встречаются редко, а чаще всего содержатся в комплексе друг с другом в различных сочетаниях, а также во взаимосвязи с другими полифенолами и веществами нефенольного характера. Отсюда и богатство природных красок и оттенков, обусловленных наличием антоцианов. В настоящее время известны определенные закономерности в распределении естественной окраски растительных органов. Так, с усилением степени гидроксилирования бокового кольца Б в молекуле антоцианидинов (т. е. с увеличением числа групп ОН) в окраске преобладают синие тона (рис. 7). Это так называемый «дельфинидиновый тип» антоцианов. Процесс гидроксилирования протекает под действием ферментов фенолоксидаз. В дельфинидиновом комплексе могут быть и другие антоцианы с ОН-группами в боковом кольце — цианин и пеларгонии, но преобладающим антоцианом является дельфинин.

Рис. 7. Схема гидроксилирования антоцианов, в результате чего усиливается их синяя окраска
При усилении степени метилирования антоцианидинов (т. е. присоединения групп СН3 в кольце Б) в природной окраске начинают преобладать красные тона (рис. 8). Так формируется «мальвидиновый тип» антоцианов (при участии ферментов, которые получили название метилтрансфераз). Вместе с преобладающим в этом типе антоцианов энином (гликозид мальвидина) могут находиться пеонин и петунин. Строгой границы между этими двумя типами антоцианов в естественных условиях не существует. Эти флавоноиды обычно располагаются в клетках комплексно, нередко в соединениях с металлами, отчего гамма природных красок еще больше обогащается. Металлы кальций и магний, например, усиливают синие тона, калий — красные. Наличие желтых каротиноидов, а также флавонолов и флавонов (о них речь будет идти дальше) придает «антоциановым» лепесткам цветков своеобразные оранжево-желтые оттенки. Это хорошо заметно, например, на цветках фиалки трехцветной, известной в народе под названием «анютины глазки».

Рис. 8. Схема метилирования антоцианов, в результате чего усиливается их красная окраска
Это нежное растение и в самом деле как бы удивленно смотрит на окружающий мир своим любопытным и в то же время задумчивым разноцветьем взглядов. Англичане и французы дарят цветки анютиных глазок при расставании друзей как память о себе, о своей родине. Этой чести цветок удостоился благодаря сложному ансамблю красок, обусловленному сочетанием антоцианов с другими растительными пигментами.
Английские биохимики Г. Робинсон и Р. Робинсон еще в 30-х годах обратили внимание на тот факт, что отдельные виды антоцианов не разбросаны беспорядочно по растительному миру, а приурочены в основном к определенным семействам. Например, в цветках пасленовых, губоцветных, первоцветных преобладает дельфинидиновый тип антоцианов, совершенно отсутствующий в лепестках розоцветных. Действительно, присмотритесь к голубым лепесткам цветков фиалок — и вы сразу сможете определить, что антоцианы их имеют гидроксилированное боковое кольцо в своей молекуле.
А сине-фиолетовые цветочки будры, упрямо выставляющие себя из листовых пазух вверх, навстречу солнцу? Конечно же, в них также преобладают дельфинин и его производные. В Белоруссии будру можно повсеместно встретить вдоль дорог, по полям, склонам, кустарникам, на лесных опушках. Цветки ее нашли лечебное применение в профилактике заболеваний, связанных со свинцовым отравлением у людей, чья профессия связана с малярным производством и работой в художественных мастерских (М. И. Нейштадт, 1963). Антоцианы будры связывают ядовитые ионы свинца и других тяжелых металлов, попавшие в организм человека, и выводят их наружу.
В лепестках роз, как уже говорилось, нет дельфинина. Их ало-красный цвет обусловлен метилированными антоцианами — мальвидином и его производными. Словом, каждое семейство приобрело в процессе эволюции растительного мира способность накапливать определенные типы антоцианов и передавать это свойство по наследству.
А как же «ведут себя» антоцианы в результате появления мутаций (т. е. наследственных изменений определенных признаков) при скрещиваниях? Сотрудница Кембриджского университета Р. Скотт-Монкрифф опубликовала еще в 1938 году результаты своих наблюдений, сделала вывод о том, что наследственные изменения окраски цветков всегда направлены от дельфинидина к цианидину и затем — к пеларгонидину, т. е. от фиолетово-голубого цвета к синему и затем — к красному. Эти наблюдения послужили в дальнейшем основой биохимического изучения вопросов наследования других признаков у растений. Л. А. Семкина (1973, 1974) установила, что формы барбариса с постоянной антоциановой окраской (пурпурнолистные барбарисы) накапливают преимущественно гликозиды пеонидина, с временной (зеленолистные барбарисы) — цианидина.
Антоцианы в клетках обычно растворены в клеточном соке и сосредоточены в вакуоли, где концентрация их достигает значительных величин. Корнеплод столовой свеклы, например, кажется кроваво-красным от обилия в клеточном соке антоцианов. Образуются и накапливаются эти флавоноиды и в других растительных органах — стеблях и листьях. Известный немецкий ботаник Г. Молиш еще в 1905 г. описал различные виды кристаллических антоцианов, накапливающихся в клетках листьев красной капусты. Они имели форму зернышек, игл, шаровидных образований, располагавшихся в клетках мякоти листа непосредственно под его верхней кожицей (рис. 9).
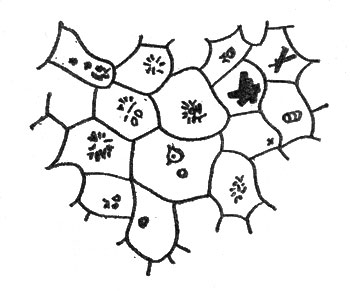
Рис. 9. Мякоть листьев красной капусты с кристаллами антоцианов при увеличении в 160 раз (по Г. Молишу, из В. Н. Любименко)
В дальнейшем антоцианы неоднократно выделялись в кристаллическом виде из различных органов растений. Путем сравнения их с уже известными соединениями каждый выделенный антоциан идентифицировался, т. е. для каждого из них устанавливали (по имеющимся образцам) точное химическое строение и определяли название. Чаще всего кристаллы выделенных антоцианов имеют палочковидную форму. Так, кристаллы мальвидинового типа (мальвидин-3-моногликозида), выделенные из кожицы винограда сорта Саперави, имеют вид розовых палочек без острых концов (рис. 10). Канадская исследовательница К. Ноззолилло (1972) указывает, что в изученных ею 42 видах двудольных растений из 30 семейств антоцианы обнаруживаются преимущественно в верхней кожице молодых проростков, реже — в нижележащих слоях клеток. Скопления антоцианов в клетках хорошо видны в виде темных точек.
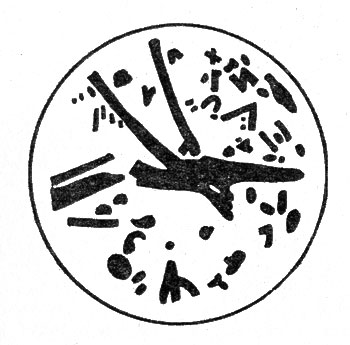
Рис. 10. Кристаллы мальвидина, выделенные из кожицы ягод винограда сорта Саперави (по М. А. Бокучава с сотрудниками)
Важное значение в образовании антоцианов имеет свет. Например, некоторые сорта яблок краснеют только с солнечной стороны. Естественную окраску приобретают плоды слив, вишен, черной смородины по мере получения все новых и новых порций солнечного света. Иссиня-черный цвет быстрее приобретают те ягоды черники, которые произрастают на более освещенных участках («световая» черника). По нашим наблюдениям (И. А. Карабанов. В. А. Шуберт, 1972), при полном созревании черники «световые» ягоды (на открытых участках леса) накапливают в кожице и мякоти 720 мг антоцианов в расчете на 100 г сырого веса, в то время как «темновые» (на затененных участках) — только 600 мг, т. е. на 20 % меньше. Близкородственная чернике голубика, произрастающая, как правило, в менее освещенных условиях, накапливает ко времени сбора ягод в 1,5 раза меньше антоцианов по сравнению с черникой.
Хорошо известно, что в одном и том же семействе существуют разновидности растений с постоянной зеленой окраской листьев, в то время как у других форм в течение всей вегетации листья окрашены в пурпурный, красновато-фиолетовый, т. е. «антоциановый» цвет (например, разновидности капусты, барбариса и др.). Но присмотритесь внимательнее к кустам красноцветной формы барбариса. Оказывается, антоцнановую окраску имеют листья только хорошо освещенной части кроны. Внутри же куста, куда попадает лишь рассеянный свет или вообще не доходят солнечные лучи, листья окрашены в обычный зеленый цвет. Аналогичное явление в окраске стебля мы обнаружим у гречихи, если внимательно обследуем растения на краю и в середине посева, а также в изреженной и загущенной части его. Мы непременно заметим, что одни стебли имеют четко выраженный антоциановый цвет, другие же, находящиеся в худших условиях освещения, имеют бледновато-зеленую окраску, с еле заметными признаками антоцианов, а то и вовсе без них.
Проростки многих растений, склонные к накоплению антоцианов, лишь только пробив почвенный покров и подставив первые листочки солнцу, сразу же образуют в клетках эти флавоноиды. Своей хорошо заметной антоциановой окраской выделяются в поле среди других хлебных злаков проростки ржи. Это свойство ее, между прочим, является одним из характерных признаков, по которому отличают рожь от пшеницы, ячменя, овса. При освещении проростков проса светом в 12 тысяч люкс междоузлия его за одни сутки становятся красными от образовавшихся антоцианов.
Свет — определяющее условие образования и накопления антоцианов для всех видов и форм растений. В условиях похолодания действие света на накопление антоцианов в растениях усиливается.
Почему же так чувствителен растительный организм к действию света, что нередко при самой незначительной порции его начинается образование антоциановых пигментов? Ключом к решению задачи послужили исследования группы американских ученых в Белтсвилле М. Паркера, Г. Бортвика, С. Хендрикса, У. Батлера, Г. Сигелмана в конце 40-х — начале 50-х годов нашего века. Они обнаружили, а затем и выделили чувствительный к действию света белок, который получил название фитохром (от греческих «фитон» — растение, «хрома» — краска). Выяснилось, что этот белок существует в растительных клетках в двух формах, которые под действием света с определенной длиной волны обладают способностью превращаться друг в друга. Какой же свет улавливается фитохромом?
Во-первых, красный (КС) с длиной волны около 660 ммк, во-вторых, так называемый дальний красный (ДКС) с длиной волны около 730 ммк. Соответственно этому первая форма фитохром а, являющаяся неактивной, получила название КС-формы, вторая — активная — ДКС-формы. КС-форма при поглощении кванта (порции) «своего» света превращается в ДКС-форму и приобретает способность поглощать дальний красный свет. Под действием его ДКС-форма начинает поглощать красный свет, превращаясь в КС-форму. Аналогичное влияние на ДКС-форму фитохрома оказывает темнота: она переводит его в неактивное состояние (КС-форму), только гораздо медленнее, чем соответствующий свет. Таким образом, фитохром существует и на свету, и в темноте, но только в первом случае его больше в активном состоянии, во втором — в неактивном.
Какое же отношение имеет этот светочувствительный белок к образованию антоцианов? Исследованиями Г. Мора (ФРГ), Г. Сигелмана и С. Хендрикса (США), Н. П. Воскресенской и Д. М. Гродзинского (СССР) и других ученых установлено, что образование антоцианов в растительных клетках находится под обязательным контролем фитохрома, точнее — его активной формы, а скорость этого процесса зависит от количества ее: больше образовалось ДКС-фитохрома в клетках под действием света — больше накапливается и антоцианов. По наблюдениям американских ученых У. Бриггса и Г. Сигелмана (1965), молодые проростки больше всего содержат активной формы фитохрома в 4-6-дневном возрасте. Этому возрасту, как установили А. А. Булах и Д. М. Гродзинский (1970), и соответствует максимальное содержание антоцианов в проростках ржи — растения, которое дает четкий «антоциановый» ответ при активизации его фитохрома красным светом.
Только ли на начальных этапах роста образование антоцианов контролируется фитохромом? Оказывается, нет. Ведь хорошо известны растения, стебли и листья которых имеют четко выраженную антоциановую окраску в течение всего периода вегетации (например, гречиха, горец и другие представители семейства гречишных). А покраснение яблок, вишен, слив, наступающее при их созревании, т. е. на завершающем этапе развития плода? У периллы масличной, например, усиленное образование антоцианов происходит лишь накануне цветения, и опять-таки в этом процессе участвует фитохром. Профессор Д. М. Гродзинский считает контролирующее действие этого светочувствительного белка на биосинтез антоцианов универсальным механизмом в растительном мире. Фитохром служит удобным индикатором, позволяющим выявить наличие у растений эффекта «красный свет — дальний красный свет».
Выше мы уже говорили о роли фермента ФАЛ в биосинтезе флавоноидов. М. Н. Запрометов (1974) указывает, что дальний красный свет, вызывая образование антоцианов, одновременно резко усиливает активность фермента ФАЛ: в течение 6-18 часов нарастание обоих процессов протекает параллельно. Другими словами, образование и накопление антоцианов в клетках соперничает с биосинтезом белка. Исход этого соперничества решается, как и у других флавоноидов, на уровне «перехвата» аминокислоты фенилаланина (тирозина), которая расходуется на построение и молекул белка, и молекул антоцианов.
Таким образом, работе фитохромной системы и усилению деятельности ФАЛ, обеспечивающих образование антоцианов, всегда противостоит работа других ферментов, ответственных за новообразование белковых молекул. В 50-х годах нашего века американские ученые К. Тиман и И. Эдмондсон установили, что для образования и накопления антоцианов важное значение имеет наличие микроэлемента меди. Добавление ее в питательный раствор всегда приводит к усилению антоциановой окраски. Медь образует с антоцианами устойчивые комплексы, она же входит в состав некоторых ферментов, под контролем которых находятся процессы образования антоцианов и других флавоноидов.
Каковы же функции антоцианов в растительном организме? На сегодняшний день однозначного ответа на этот вопрос не существует. В попытке решить его еще в начале XIX века сталкивались различные точки зрения. В нашу задачу не входит изложение всех их, подчеркнем лишь, что многие исследователи сходятся в едином мнении о защитной роли антоцианов, предохраняющих растительный организм от губительного действия пониженных температур. Выше мы уже отмечали, что при понижении температуры воздуха усиливается действие света на образование антоцианов, при этом листья и стебли различных растений заметно приобретают красноватый оттенок. В начале XX столетия в числе первых интересные наблюдения в этом направлении провели немецкие ботаники Г. Клебс и Г. Фиттинг. Выращивая комнатные декоративные растения при различных температурных условиях, Г. Клебс (1906) заметил, что нежные небесно-голубые колокольчики при повышении температуры воздуха постепенно тускнеют, окраска их в значительной мере ослабевает. Другой исследователь Г. Фиттинг во время своего пребывания в Бейтензоргском ботаническом саду на о. Ява (1912 г.) подобное явление наблюдал в опытах с геранью. При изменении температуры от 20 °С и выше синие цветки этого растения краснели, затем розовели и, наконец, обесцвечивались. Постепенное же похолодание придавало лепесткам их первозданный вид. Характерно, что для каждого интервала температур отмечена была своя индивидуальная гамма оттенков в лепестках цветущей герани.
Со времени этих наблюдений прошло много лет, но неизменно многочисленными путешественниками и исследователями отмечалось и отмечается, что в местностях с более суровыми климатическими условиями растения накапливают в своих органах больше антоцианов. Это особенно касается растительности северных широт, а также альпийской природно-климатической зоны. На III Всесоюзном семинаре по биологически активным (лечебным) веществам плодов и ягод (г. Свердловск, сентябрь 1966 г.) весьма актуально прозвучал и с интересом был встречен доклад И. Ф. Борух (Львовский торгово-экономический институт), в котором автором были приведены обстоятельные сведения по накоплению антоцианов в ягодах земляники, малины, черники, ежевики и брусники в зависимости от растительного пояса Карпатских гор. Эволюционная приспособленность ягодников к более суровым условиям произрастания выработала у них свойство накапливать больше антоцианов не только в листьях, но и в плодах. Наиболее ценные ягоды по содержанию антоцианов были у всех исследованных растений субальпийского пояса. Меньше этих флавоноидов накапливается в ягодах горно-лесного и еще меньше — предгорного поясов.
Многие ученые едины в том, что защитный механизм растений от холода путем накопления антоцианов состоит в дополнительном поглощении ими солнечного света, именно той его части, которая в меньшей мере улавливается хлорофиллом. Антоцианы таким путем как бы согревают «продрогшее» растение. Агроном-селекционер Н. И. Малютин, исследовав географическое распространение различных видов дельфиниума, отмечает, что способность ярко окрашенных его цветков собирать дополнительное количество солнечной энергии имеет важное значение для опыления и оплодотворения в условиях пониженных температур. Он сравнивает в этом отношении работу «антоциановых» лепестков у арктических форм дельфиниума с работой солнечной печи: задерживая внутри цветка часть солнечной энергии, лепестки обогревают пестик и тычинки. Это позволяет создать внутри цветка свой микроклимат, который надежно обеспечивает осуществление процесса оплодотворения в условиях холода. Кроме того, агликоны антоцианов содействуют накоплению сахаров, связываясь с ними в гликозиды (рис. 2). Они становятся своеобразными центрами притяжения сахаров — этих поставщиков энергии для клеток.
Все это вместе взятое содействует повышению устойчивости растительного организма против холода.
Антоцианы принимают участие в дыхании растений в качестве переносчиков электронов от дыхательного материала (жиров, сахаров и др.) на кислород воздуха. Впервые на эту их роль указал известный русский биохимик В. И. Палладин. Он назвал антоцианы «дыхательными пигментами», которые принимают водород (электрон) от дыхательного материала и передают его на кислород воздуха. При этом сами они попеременно то восстанавливаются, то окисляются. Присоединив водород, дыхательные пигменты превращаются в так называемые «дыхательные хромогены». «Красная и фиолетовая окраска молодых побегов есть дыхательная окраска», — писал В. И. Палладин в своей работе «Образование и распространение дыхательных хромогенов в растениях» еще в 1908 г. Взгляды ученого предвосхищали уровень тогдашней мировой научной мысли на полстолетия.
В настоящее время благодаря последующим исследованиям А. И. Опарина (СССР), А. Сцент-Дьердьи (Венгрия) и других ученых установлено, что многие полифенолы (в том числе и антоцианы) способны окислять дыхательный материал в клетках при участии ферментов фенолоксидаз и пероксидазы. Эту работу они производят на заключительных этапах сложного дыхательного процесса.
Таким образом, принимая участие в дыхании, антоцианы тем самым содействуют обеспечению растительных клеток энергией, поскольку дыхание — это универсальный природный процесс освобождения энергии, заключённой в химических связях окисляемых веществ («дыхательного материала»). Больше антоцианов в растениях — значит, гарантируется лучшая энергообеспеченность их. Так, исследованиями Л. А. Семкиной (1973, 1974) обнаружено, что у барбариса с постоянной антоциановой окраской листьев, как правило, поддерживается повышенная интенсивность дыхательного процесса в течение всего периода вегетации по сравнению с зеленолистными формами этого растения. Автор указывает, что у барбарисов с окрашенными листьями постоянно действует своеобразный «антоциановый цикл», который производит систематическое отторжение некоторой части продуктов обмена веществ для своих нужд. Нормальное течение основных жизненных процессов при этом не подавляется, и сложившееся биохимическое равновесие в растительном организме не нарушается.
Интересные опыты были проведены в Украинской сельскохозяйственной академии (г. Киев) Р. В. Нагорной (1968, 1974). Она вводила искусственным путем (так называемым методом вакуум-инфильтрации) антоцианидины в проростки ржи и пшеницы и определяла интенсивность дыхания у таких обогащенных этими флавоноидами растений. Что же выяснилось? Оказывается, что опытные проростки ржи и пшеницы поглощали кислород («дышали кислородом») в зависимости от возраста на 23-53 % интенсивнее по сравнению с контрольными. Антоцианы у них как бы «возбуждали аппетит» к ускорению переработки дыхательного материала клеток. При этом у них значительно возрастала активность окислительных ферментов (пероксидазы, аскорбиноксидазы), которые принимают участие в акте дыхания на его заключительных этапах. Автор считает эту роль антоцианов в дыхательном процессе — активацию ферментов — основной физиологической ролью в растительном организме, благодаря которой повышается устойчивость растений к различным неблагоприятным условиям.
«Антоциановые» растения обладают повышенной стойкостью не только к холоду, но и к кислым газам, которые выбрасываются в окружающую среду промышленными предприятиями. Многие авторы считают, что противодействие вредным газам у красноцветных форм растений основано на способности антоцианов к реакциям ацилирования, т. е. присоединения к своим молекулам различных кислотных остатков. Заметим, что антоцианы сравнительно легко присоединяют такие остатки к ОН-группам, а также к сахарной части молекул. А остатков этих в условиях загазованности воздуха всегда в избытке. В настоящее время хорошо известно, что те растения, которые склонны к накоплению антоцианов, в условиях промышленного задымления реализуют эту способность более активно: сказывается быстрое действие неблагоприятных условий, в которые попадает организм, и сразу же срабатывает внутренний механизм самозащиты.
Таким образом, наличие антоцианов в листовом аппарате создает своеобразный природный фильтр, предохраняющий растения (да и окружающую среду) от загазованности. Исследованиями Б. П. Строганова и его сотрудников установлено, что на засоленной почве растения краснокочанной и белокочанной капусты, а также красной периллы приобретают повышенную способность к накоплению антоцианов. Таким методом они как бы предохраняют себя от вредного действия почвенных солей, не дают возможности образоваться в клетках другим токсическим соединениям.
Словом, антоцианы ограждают растительный организм от многих подстерегающих его опасностей. Одна из таких опасностей — поедание растений животными. Еще в конце XIX столетия рядом исследователей ставились опыты, которые показали, что при прочих равных условиях кролики и овцы предпочитают лакомиться зелеными листьями, оставляя нетронутыми красные. И только крайняя степень голодания вынуждает их поедать листву с антоциановой окраской, если рядом нет зеленого корма.
Антоцианы цветков играют важную роль в опылении растений, привлекая к себе насекомых-опылителей (пчел, шмелей). Лепестки яблони (семейство розоцветных), например, внутри белые, но снаружи имеют нежно-розовый («антоциановый») оттенок, что и привлекает пчел. В лаборатории пчеловодства Белорусского НИИ картофелеводства и плодоовощеводства установлено, что мед, выработанный местными темными лесными пчелами, гораздо вкуснее меда пчел других пород, поскольку местная пчела чаще других посещает цветки семейства розоцветных. Яблоня — самое распространенное из этого семейства плодовое дерево в Белоруссии. Подсчитано, что для сбора 100 г меда пчела должна посетить около миллиона цветков. Отыскать их помогают антоцианы. Как компас в открытом море природы, указывают они этим насекомым-труженикам верный путь.
В числе других флавоноидов антоцианы проявляют Р-витаминное действие на организм человека и животных, поддерживают нормальное состояние кровяного давления и сосудов, предупреждая тем самым опасную возможность внутренних кровоизлияний. Выше мы указывали, что антоцианы обладают способностью образовывать комплексы с ионами некоторых металлов, обогащая при этом гамму природных красок. Это свойство антоцианов оказалось особенно полезным для защиты организма человека от попадающих в него радиоактивных элементов. Образовавшиеся, например, комплексы антоцианов с радиоактивным кобальтом долго не задерживаются в организме и выводятся из него. Тем самым предупреждается губительное действие радиоактивных элементов.
Каковы же природные растительные источники антоцианов? На одно из первых мест в этом отношении претендует арония, или, как ее называют, черноплодная рябина. Это плодовое и декоративное растение, введенное в культуру еще И. В. Мичуриным, с сочными кисло-сладкими ягодами, имеющими ярко выраженный терпкий привкус. В зрелом состоянии они накапливают, по данным Центрального ботанического сада АН БССР, до 5 г антоцианов на каждые 100 г сырого веса. Цифра эта — одна из самых рекордных. Если учесть, что суточная потребность человека в Р-активных веществах составляет около 100 мг, то нетрудно себе представить, что горсть плодов аронии удовлетворит суточную норму в витамине Р у 50 человек.
Сок и ягоды аронии благодаря высокому содержанию антоцианов успешно применяют в клинической практике для лечебных и профилактических целей при гипертонии и других заболеваниях, связанных с повышенной проницаемостью кровеносных сосудов. Вот как описывает, например, врач В. С. Орешникова (1964, 1968) результаты лечения 110 больных гипертонией I и II стадий с преимущественным поражением сосудов головного мозга в одной из клиник г. Омска: «В результате проведенного лечения соком черноплодной рябины у большинства больных улучшилось самочувствие, снизилось артериальное давление, повысилась трудоспособность.
…Сок черноплодной рябины обладает гипотензивным действием, а по данным хронаксии и биотоков мозга — улучшает корково-подкорковые соотношения и может быть использован для лечения больных гипертонической болезнью I и II стадии. При повторных курсах лечения плодами и соком черноплодной рябины наблюдается улучшение самочувствия и снижение артериального давления». Методика применения плодов и сока аронии в лечебных целях оказалась весьма простой: плоды используются в расчете по 100 г, а сок — по 50 мл на человека 2-3 раза в день в течение 3-8 недель. Эффективность их, как правило, была одинаковой.
Какие еще плоды богаты антоцианами? Все, имеющие темно-красный и иссиня-черный цвет: черной смородины, вишни, сливы, ежевики, черники, голубики и др.
Накапливаться антоцианы начинают в кожице плодов с момента появления бурой окраски. По данным Г. Б. Самородовой-Бианки (1961), высоким содержанием антоцианов отличаются ягоды черной смородины сортов Нарядная, Смена, Голубка, Голландская черная (610-920 мг в расчете на 100 г сырого веса, или мг %), вишня сортов Ширпотреб черная и Ленинградская превосходная (250-332 мг %), а также дикий крыжовник Дугласа (920 мг %), дикая жимолость Синяя (738 мг %).
В Белоруссии исследования плодов и ягод на содержание антоцианов и других Р-активных веществ были начаты в 1954 г. группой биохимиков под руководством Д. К. Шапиро (г. Минск). Были выделены наиболее богатые антоцианами сорта черной смородины Лия плодородная (419 мг %), Лошицкая (354 мг %), Гибрид 4/9 Д (343 мг %); вишни Владимирская улучшенная (438 мг %), Гриот остгеймский (250 мг %), Новодворская (218 мг %); сливы Венгерка обыкновенная (242 мг %), Иерусалимская (155 мг %), Улучшенная местная (146 мг %), Эдинбургская (158 мг %); произведена «инвентаризация» ряда дикорастущих ягодников по содержанию и накоплению Р-активных веществ. Работа продолжается сейчас в лаборатории химии растений Центрального ботанического сада АН БССР. Выделены богатые антоцианами виды ирги, содержащие до 1600 мг % этих соединений (например, ирга малоплодная); боярышника (алмаатинский, колючий, пятипестичный, йезо) с содержанием до 1500 мг % антоцианов; формы облепихи и других растений.
Самыми распространенными антоцианами в плодах и ягодах являются гликозиды цианидина. Они обнаружены в ежевике, чернике, аронии, вишне, черешне (темноокрашенной), смородине черной и красной. Ягоды клубники и земляники содержат, кроме того, гликозиды пеларгонидина, клюквы — пеонидина, смородины черной — дельфинидина. Разнообразен и состав сахаров, связанных с соответствующими агликонами. Здесь обнаружены глюкоза (антоцианы ежевики, малины, черники, бузины, аронии, вишни), рамноза (антоцианы малины), галактоза и арабиноза (антоцианы клюквы) и другие сахара.
Словом, в плодах и ягодах антоцианы представлены во всем своем многообразии как по составу агликонов (антоцианидинов), так и по набору сахаров, что вместе взятое придает естественной окраске плодов и ягод особую привлекательность и нарядность. Но, разумеется, ценность их не во внешней красоте, а в суммарном содержании Р-активных веществ. Л. И. Вигоров (1976) указывал, что богаты этими соединениями те сорта ягодных растений, у которых сразу при созревании (но не перезревании) мякоть ягод окрашивается не в зеленый, а в красноватый цвет.
Недавно выяснилось, что накоплению антоцианов в яблоках содействует новый способ культивирования яблонь — создание так называемых пальметтных садов. Это сады, в которых яблони не имеют привычных для нас крон, а сформированы из отдельных ветвей, ориентированных в пространстве вертикально и горизонтально. Пальметтный сад представляет собой низкорослое насаждение с гирляндами плодоносящих ветвей, плети яблок которых щедро освещаются солнечными лучами. Здесь нет затененных ветвей, поэтому возможность для образования антоцианов в кожице яблок в таком саду гораздо большая, чем в обычном. По данным Н. С. Посохляровой (1975), в яблоках сортов Джонатан и Вагнера призовое в условиях пальметтного сада в Крыму антоцианов накапливалось ко времени съемной зрелости плодов значительно больше по сравнению с яблоками таких же сортов в условиях обычного сада. Пальметтные сады, созданные уже в Казахстане, Молдавии, Крыму, на Северном Кавказе, дают возможность не только интенсифицировать плодоводство, но и обеспечить образование повышенного количества антоцианов в яблоках, добиться максимального выхода Р-активных веществ с единицы площади.
Важным источником антоцианов являются ягоды темно-окрашенных сортов винограда. Кожица и мякоть их обладают высокой способностью накапливать антоцианы. М. В. Тютюнник и В. И. Сивцев (1968) установили, что у ряда крымских сортов винограда (Забалканский, Тайфи розовый, Додреляби и др.) образование комплекса антоцианов начинается с мальвидина, затем синтезируется пеонидин (в соединении с глюкозой). Такая закономерность, по их мнению, является общей для всех окрашенных сортов культивируемого винограда. С. В. Дурмишидзе указывает, что примерно третья часть обнаруженных в винограде антоцианов приходится на мальвидин. Появление антоцианов раньше начинается в кожице, где набор их всегда разнообразнее, чем в мякоти. Л. И. Вигоров (1976) отмечал, что Р-активные антоцианы кожицы при пищеварении усваиваются слабее, поэтому в селекции винограда следует ориентироваться на те сорта, у которых окрашена не кожица, а сама мякоть. Но таких сортов, к сожалению, имеется гораздо меньше.
В наших исследованиях, проводившихся в 1971-1973 гг. совместно с Ф. Г. Бардиновым и В. А. Говорухиным на любительской плантации в окрестности г. Минска, изучалось накопление различных форм флавоноидов (в том числе и антоцианов) в 26 сортах винограда преимущественно селекции Центральной генетической лаборатории имени И. В. Мичурина (г. Мичуринск) и Центрального ботанического сада АН БССР. Выяснилось, что наибольшую ценность по суммарному содержанию биологически активных флавоноидов представляют сорта и гибриды винограда с ярко выраженной антоциановой окраской ягод (И. А. Карабанов и др., 1972). Среди них выделяются № 1 Филиппенко (325 мг %), Минский 8-29 (277 мг %), Минский 8-22 (166 мг %) и другие. Следует особо отметить такие сорта и гибриды этой группы, как Космонавт Т-4; 3-17-27; 1-14-110, Минский 8-24, Юбилейный Удмуртии. Они накапливают от 2,5 до 3,9 мг биофлавоноидов в расчете на одну ягоду, характеризуются отличными вкусовыми качествами ягод, сравнительно ранним созреванием урожая (конец августа — вторая декада сентября), качественным вызреванием лозы. Флавоноиды ягод антоциановых сортов белорусского винограда представлены как наиболее окисленными, так и наиболее восстановленными формами. При этом по накоплению окисленных полифенолов выделяются Минский 8-29 (антоцианы и флавонолы), восстановленных — № 1 Филиппенко (лейкоантоцианы и катехины).
Из 26 исследованных нами сортов и гибридов белорусского винограда, культивируемого в течение ряда лет, 9 отнесено к группе слабоантоциановых. Ягоды их окрашены в нежно-розовый цвет. По суммарному содержанию биофлавонондов среди них выделяются Тамбовский розовый (98 мг-%), Изобильный Филиппенко (93 мг*%), ЦГЛ 2-7-2 (91 мг*%), Минский 8-32 (71 мг*%), Звездочка (72 мг*%).
Весьма разнообразен качественный состав комплекса антоцианов в ягодах винограда из антоциановой и слабоантоциановой групп. Так, в ягодах Минского 8-24 найдено 11 антоциановых гликозидов, Космонавта Т-4 — восемь. Минского 8-32 — семь. Все они сравнительно хорошо разделяются на хромато-графической бумаге и светятся в ультрафиолетовом свете различными оттенками красно-сине-фиолетового цвета. Начинают они накапливаться в конце первой декады августа, и к концу месяца содержание их возрастает в 6-7 раз по сравнению с первоначальной величиной. В ягодах слабоантоциановой группы (с нежно-розовой кожицей) биосинтез антоцианов задерживается примерно на 8-10 дней. Первоначально они (что отмечено и другими авторами) образуются в кожице, а затем, по мере созревания ягод, появляются и в мякоти. Суммарная концентрация их в ягодах антоциановых и слабоантоциановых сортов и гибридов во время интенсивного роста ягод (середина августа), по нашим наблюдениям, минимальная. Кожица ягод, являющаяся местом первичного образования антоцианов, накапливает и другие биоактивные флавоноиды. Так, в мякоти ягод сортов Космонавт Т-4, Минский 8-32 совсем не обнаружены флавонолы, в то время как в кожице содержание их достигает значительных величин (о флавонолах еще речь будет идти дальше). Там же сосредоточено до 150 мг*% антоцианов, в мякоти же ягод этих сортов обнаруживаются только следы антоцианов.
К сожалению, виноградарство в Белоруссии носит пока только любительский характер, если не считать редкую для республики Пинскую коллекцию винограда, созданную И. И. Шевчуком, на базе которой существует сейчас опорный пункт БелНИИ картофелеводства и плодоовощеводства. Проведенные нами исследования по флавоноидному составу белорусского винограда (а проводились они в республике впервые) показали, что культура эта весьма перспективна как хороший источник биологически активных антоцианов (и других флавоноидов), к тому же лоза хорошо вызревает до наступления холодов и неплохо переносит зиму.
Много антоцианов накапливают дикорастущие ягоды белорусских лесов. Содержание этих флавоноидов по годам исследований подвержено нередко сильным колебаниям. По определениям Г. В. Сенчук (1973), количество антоцианов в зрелой клюкве колеблется от 397 до 682 мг*%, в голубике — от 107 до 475, в бруснике — от 134 до 365, в чернике — от 649 до 698 мг*%. Для всех ягод, кроме голубики, характерно наличие природных пигментов как в кожице, так и в мякоти. Дикорастущие ягоды богаты не только антоцианами, но и катехинами (о них речь будет идти дальше).
Таким образом, вместе с антоцианами в ягодах очень часто группируются другие формы Р-активных веществ. Наличие антоциановой окраски у растений обычно свидетельствует о накоплении в их тканях не только антоцианов, но и других флавоноидов. Нередко видимая антоциановая окраска маскирует скопившиеся другие группы флавоноидов, отделить которые друг от друга можно химическими методами.
Присмотрись, читатель, внимательнее к окружающей природе, поищи вокруг себя ярко выделяющиеся синие, красные, голубые, фиолетовые цветки, плоды, листья и стебли — и ты убедишься, что антоцианы всюду окружают тебя. Они имеются во многих тканях и органах растения. Иными словами, нельзя приурочивать образование антоцианов к каким-либо одним только участкам растительного организма.
Теперь ты знаешь, что эти флавоноиды не только украшают природу, но и представляют ценность для человека как составная часть большого Р-витаминного комплекса веществ, весьма необходимых для поддержания его нормального здоровья.
Лейкоантоцианы — растительные «хамелеоны»
Человек неукротимо
Хоть и смертен, но стремится
Знать и то, что видит зримо,
И что в вечной тьме таится.
Иван Гундулич
О том, что удивило русского ученого. — Скрытые антоцианы? — Возможные помощники клеточного деления. — Союз «невидимок» с известным витамином. — Природные полимеры — защита и опора клеток. — Всегда на страже.
В 1914 г. в «Известиях Императорской Академии наук» была помещена статья с лаконичным названием «Об искусственном антоциане». Автор ее — замечательный русский ученый, работавший тогда профессором кафедры ботаникии и микробиологии Варшавского политехнического института, Михаил Семенович Цвет сообщал интересные для того времени факты. Он наблюдал мгновенное покраснение яблок, бананов, груш, винограда, а также белых лепестков роз и цикламена после обработки их слабой соляной кислотой с последующим нагреванием. Полученный красный пигмент осаждался из раствора, его можно было собрать на обыкновенной промокашке. Ученый назвал это вещество, удивившее его своими необычными свойствами, искусственным антоцианом. Почему?
Потому, что, как оказалось, оно имеет некоторое сходство с уже известными естественными антоцианами: в растворе оно постепенно выцветало, а от прибавления кислот (соляной, серной, уксусной) восстанавливало свою фиолетово-красную окраску. Искусственный антоциан М. С. Цвета обладал поразительной способностью изменять свой «внешний облик»: от действия щелочи он зеленел, от кислоты — краснел, а фенилгидразин и сернокислый натрий мгновенно обесцвечивали его. Ученый отозвался о выделенном им веществе как о «растительном хамелеоне» и высказал предположение, что этот «хамелеон» должен быть весьма близок по строению к естественным антоцианам.
Так оно и оказалось в дальнейшем. Так М. С. Цвет открыл в растениях группу бесцветных флавоноидов, получивших позже название лейкоантоцианов (от греческого «лейкос» — белый) — бесцветных антоцианов (в дословном переводе — бесцветных синих цветков).
Лейкоантоцианы представляют собой группу чрезвычайно неустойчивых флавоноидов. По своим химическим свойствам они примыкают близко к наиболее восстановленным полифенолам — катехинам, очень часто сопутствуют им в клетках растительного организма. Замечено, что во многих случаях лейкоантоцианы «ведут себя» подобно антоцианам: они накапливаются под действием света и при достаточном количестве сахаров; как и антоцианы, они содержатся в значительных количествах в бутонах и цветках. Создается впечатление, что лейкоантоцианы, как невидимые спутники, как бы подстраховывают существование антоцианов.
В настоящее время установлено, что они и в самом деле служат резервом для образования антоцианов: будучи «невидимками», они при соответствующих условиях довольно быстро превращаются в эти хорошо заметные растительные пигменты. Благодаря такому свойству лейкоантоцианы и были обнаружены М. С. Цветом в тканях различных растений. За свою бесцветность и возможность быстрого превращения в антоцианидины агликоны лейкоантоцианов получили название лейкоантоцианидинов (бесцветных антоцианидинов). Из них больше всего в растительном мире распространены лейкоцианидин и лейкодельфинидин.
Словом, лейкоантоцианы — это во многом скрытые, замаскированные антоцианы. Французский ученый П. Риберо-Гайон в своей книге «Растительные фенолы» (1972) замечает, что в самом термине «лейкоантоцианы» заключен парадокс: этим термином обозначают всю сумму веществ, способных превращаться в антоцианы. Такая возможность действительно установлена на примере целого ряда растений. Так, А. Д. Боброва (1973) наблюдала, что у кормового растения эспарцета закавказского в бутонах, цветках и плодах наблюдается обратная зависимость между содержанием антоцианов и лейкоантоцианов: по мере возрастания количества первых уменьшается содержание вторых. Вполне естественно напрашивается вывод о том, что по мере формирования цветков часть лейкоантоцианов превращается в антоцианы, пополняя запасы клеток лепестков этими хорошо заметными для насекомых флавоноидами.
Подобная закономерность обнаружена нами при сравнительном изучении распределения флавоноидов в цветках, листьях и стеблях близкородственных растений с хорошо заметной антоциановой окраской стебля — гречихи и горца забайкальского, культивируемых в окрестности г. Гомеля. Стебли горца забайкальского содержат во время цветения 29 мг*% (в расчете на сырой вес) антоцианов и 336 мг*% лейкоантоцианов. К этому времени антоцианы в листьях уже не обнаруживаются, хотя ранее, до цветения, они были видны невооруженным глазом.
А что же лейкоантоцианы? Их ко времени цветения особенно много собирается в верхних листьях — до 1260 мг*%. Ясно, что эти листья, расположенные в непосредственной близости к точкам роста и цветкам, накапливают в наиболее ответственный период развития растительного организма (бутонизация и цветение) максимальное количество этих невидимых флавоноидов, способных в любое мгновение по соответствующему «запросу» обнаружить себя в виде антоцианов.
При сравнении гречихи сортов Юбилейная 2 и Тетраплоидная мы установили, что цветки первой из них содержат до 500 мг*% лейкоантоцианов, второй — до 720 мг*%. Большему накоплению лейкоантоцианов в цветках соответствует минимальное количество антоцианов в них, и наоборот. Создается впечатление, что лейкоантоцианы и в этом растении служат как бы своеобразным фондом для образования антоцианов.
Известный английский биохимик Дж. Харборн (1962) указывает, что путь формирования антоциановых молекул гораздо длиннее, чем некоторых других флавоноидов. Поэтому не исключено, что в процессе длительного эволюционного развития растения выработали в себе способность в какой-то мере иметь запасной, более короткий путь обеспечения себя антоцианами за счет использования веществ типа лейкоантоцианов.
Таким образом, внешнее отсутствие привычной красно-фиолетовой окраски в цветках, плодах, листьях не всегда свидетельствует об отсутствии реальной возможности биосинтеза антоцианов.
Сравнивая гречиху сортов Богатырь, Юбилейная 2, Тетраплоидная и Татарская, мы обнаружили, что последняя накапливает в своих цветках наибольшее количество лейкоантоцианов — 1060 мг*% (все остальные — 500-750 мг*%). Она же отличается от других сортов интенсивным ветвлением стебля и сильным ростом боковых побегов, в результате чего приобретает весьма развитую кустовую форму. Эта гречиха известна как хорошее кормовое растение, формирующее обильную зеленую массу. По многочисленным литературным данным (В. И. Савин, А. А. Шутов, 1965; В. И. Оре, З. Н. Крейцберг, В. Н. Сергеева, 1969, и др.), аналогичное действие на рост боковых побегов у других растений оказывают ионизирующие излучения: они нарушают «господство» верхушечной почки (точки роста), при этом боковые обогащаются продуктами фотосинтеза и другими жизненно важными веществами, в результате чего растения начинают интенсивно ветвиться.
Мы испытали действие гамма-радиации на гречихе сорта Юбилейная 2: семена подвергали облучению радиоактивным кобальтом мощностью 200 рад/с накануне посева (общий объем радиации составлял 10 кюри). Что же выяснилось?
Растения из опытных семян интенсивно ветвились, при этом рост главного стебля замедлялся (И. А. Карабанов, В. Е. Веремейчик, 1972). Благодаря обильному нарастанию боковых побегов, дополнительному образованию ветвей второго и третьего порядка каждое растение сформировало дополнительное количество цветков и семян. А как же изменилось при этом содержание лейкоантоцианов? Количество их в цветках, листьях и стеблях резко уменьшилось. Особенно сильному изменению подверглось содержание этих флавоноидов в верхней части стебля.
Складывается, таким образом, впечатление, что гамма- радиация вызывает повышение уровня жизненных процессов в боковых точках роста гречихи (по-видимому, и других растений), в результате чего лейкоантоцианы более активно вовлекаются в общий обмен веществ всего организма. Это тем более вероятно, что ряд радиобиологов — болгарские Я. Енчев, Л. Бозова, П. Федин и советские А. М. Кузин, В. Т. Киеце-Эйзенберг — сообщают о повышении под влиянием гамма-облучения активности ферментов пероксидазы и полифенолоксидазы, т. е. тех ферментов, которые ускоряют окисление полифенолов. Заметим, что еще в 1955 г. английский ученый Л. Аудус в журнале «Нейчер» («Природа») сообщил о том, что процесс клеточного деления (т. е. фактически активного роста) значительно ускоряется при помощи лейкоантоцианов. На IV Международном биохимическом конгрессе в Вене (1958 г.) американские биохимики Ф. Стьюард и Е. Шантц выступили с обстоятельным докладом, в котором сообщили, что при искусственном выращивании в лабораторных условиях растительных тканей добавление лейкоантоцианов в питательную среду заметно усиливает деление клеток. Использовались антоцианы, выделенные из плодов конского каштана, молока кокосовых орехов, зерен ряда растений. Действие лейкоантоцианов проявлялось не в меньшей мере, чем у общепризнанных факторов клеточного деления — фитогормонов кинетина и гиббереллина.
Хорошо известно, что всякий ростовой процесс, идет ли речь о росте стебля или корня, плода или листа, начинается с клеточного деления. Этим, по-видимому, и объясняется более высокий уровень лейкоантоцианов в гречихе сорта Татарская — растении, способном к обильному клеточному делению в боковых точках роста, в результате чего повышается ветвление побегов, интенсивно нарастает зеленая масса. Усилению роста, как известно, всегда сопутствует оживление обменных (окислительно-восстановительных) процессов в растительном организме.
Участие лейкоантоцианов в окислительных процессах показано в исследованиях ряда авторов. Например, М. Т. Головкина и Н. В. Новотельнов с сотрудниками (1967, 1968) отмечают, что выделенные из плодов шиповника лейкоантоцианы (лейкопеонидин и лейкорозинидин) обладают способностью задерживать окисление растворенной аскорбиновой кислоты (витамина С) в присутствии ионов меди. Обычно этот витамин в растворенном виде подвергается быстрому окислению и распаду, особенно под действием ионов металлов (в частности меди). Присутствие же лейкоантоцианов позволяет избежать разрушения аскорбиновой кислоты: эти флавоноиды образуют с ионами меди комплексные соединения за счет групп ОН в 3-м и 4-м положениях (рис. 3).
Лейкоантоцианы, таким образом, в этом отношении проявляют такое же свойство, как и антоцианы. В плодах шиповника они совместно с аскорбиновой кислотой создают единую систему, которая обеспечивает устойчивость обоих компонентов ее, усиливает их биологическую активность, проявляемую как в самом растении, так и при попадании плодов шиповника в организм человека. Как мы увидим позже, некоторые другие Р-активные флавоноиды проявляют по отношению к аскорбиновой кислоте защитное (или, как говорят биохимики, антиоксидантное) действие. В результате витамин С предохраняется от окисления и потери витаминных свойств. Другими словами, лейкоантоцианы (часто в комплексе с другими флавоноидами) и аскорбиновая кислота проявляют хорошо заметное явление синергизма (от греческих «син» — вместе, «эргон» — работа) — совместное действие в клетках, направленное на поддержание высокого уровня их жизнедеятельности.
Лейкоантоцианы очень часто обнаруживаются в древесине различных древесно-кустарниковых растений. Особенно много их оказалось в различных видах акации. Именно это растение явилось тем природным источником, из которого удалось впервые получить конкретный лейкоантоцианидин. Назвали его мелакацидин — в честь одного из видов акации, которое известно под названием австралийское черное дерево (по-латыни Акациа меланоксилон). Древесина этого растения ценится как материал для производства шкатулок. Из нее и был получен мелакацидин биохимиками Ноттингемского университета (Англия) Ф. Кингом и У. Боттомли в 1953 г. Затем из белой акации (по-латыни Робиниа псеудоакациа) был выделен другой лейкоантоциан — лейкоробинетин.
Белая акация является широко распространенным представителем этого рода растений, особенно в южных районах нашей страны. Это хороший медонос, неодолимо привлекающий к своим цветкам пчел. Подсчитано, что одно дерево белой акации за сезон может дать до 8 кг целебного меда. Характерно, что в отличие от меда, собранного пчелами с цветков других растений, «акациевый» мед обладает удивительным свойством прозрачности: благодаря высокому содержанию лейкоантоцианов его не всегда можно обнаружить, даже внимательно присмотревшись к сотам.
Именно на примере акации удалось решить один из вопросов биологической роли лейкоантоцианов. Оказалось, что они весьма легко подвергаются так называемой окислительной конденсации своих молекул, благодаря чему и накапливаются в древесине. Как уже говорилось выше, древесина акации и обратила впервые на себя внимание как источник для препаративного выделения лейкоантоцианов.
Что же такое окислительная конденсация? Это объединение (с участием кислорода) двух молекул органического вещества в одну более крупную структуру — димер. Димеры в свою очередь имеют свойство объединяться затем в соответствующие полимеры (от греческого «поли» — много). По способности различных полифенолов (в том числе и флавоноидов) образовывать полимеры долгое время судили об этих веществах как об отбросах в жизнедеятельности растительных организмов, как о веществах вторичных, второстепенных, которые «выбраковываются» растением в виде димеров и полимеров, Сейчас такая точка зрения вполне правомерно отрицается. Важную роль в этом сыграл капитальный труд М. Н. Запрометова «Биохимия катехинов», вышедший в 1964 г. «Господствовавший длительное время… взгляд на фенольные соединения лишь как на некие конечные продукты обмена веществ или «отходы» растительного организма должен быть окончательно отброшен», — писал ученый. Так оно и произошло согласно логике развития биохимии в последние годы.
На определенном этапе лейкоантоцианы (как и некоторые другие флавоноиды) «выходят» из обмена веществ путем образования полимеров (о чем сказано было выше). Полимеры очень нужны растущему растению по мере формирования различных его тканей, органов. Это особенно касается образования опорных и защитных структур в тканях стебля. Такими структурами являются клеточные оболочки, кора, древесина и др. Можно ли в этой связи говорить об исключении лейкоантоцианов из активной жизни растения? Конечно, нет. Оставаясь в составе полимеров, лейкоантоцианы выполняют свою активную функцию по сохранению и поддержанию в жизнеспособном состоянии «скелета» растения в целом и его отдельных органов. Следовательно, роль их в данном случае далеко не пассивна, тем более неуместным был бы разговор о таком состоянии лейкоантоцианового комплекса как об отбросовом.
Одним из важных полимеров, в образовании которого принимают участие лейкоантоцианы, является лигнин — вещество, заполняющее промежутки целлюлозного «каркаса», из которого состоят клеточные стенки. Без лигнина немыслимо формирование сосудов древесины, по которым проводится к листьям вода с растворенными в ней солями. От достаточного накопления этого полимера к осени зависит степень готовности растений к зиме, к перенесению неблагоприятных условий. Но оказывается, что полимеризация лейкоантоцианов может происходить не только при пропитывании полимером клеточных стенок стебля. Исследованиями польского физиолога растений Ст. Левака с сотрудниками было установлено, что образование димеров и полимеров лейкоантоцианов происходит и в листьях (яблоня, боярышник) в течение вегетации.
Лист — первичное место образования не только простейших единиц флавана, из которых построены молекулы флавоноидов (рис. 1), но и более сложных структур типа димеров и полимеров лейкоантоцианов. У яблони, например, максимум полимеров этих флавоноидов приходится на сентябрь, когда листовые ткани уже хорошо сформировались. У боярышника в начале вегетации содержание полимерных лейкоантоцианов в листьях намного выше, чем димерных, т. е. менее сложных. Отношение полимеров лейкоантоцианов к димерам 10 мая составляет 3,6. В дальнейшем оно снижается и к середине октября уже равно только 1,4. Все это говорит в пользу активного участия этих флавоноидов в жизнедеятельности растений. Не исключено, что изменчивость в количественном и качественном составе флавоноидов в листьях на протяжении цикла развития растений создает определенные предпосылки для организации своеобразного фонда, из которого формируется затем флавоноидный потенциал плодов. Ст. Левак с сотрудниками отмечает, что после созревания плодов боярышника наблюдается снижение общего количества лейкоантоцианов в листьях с 1350 до 1085 мг на 1 кг веса.
Лейкоантоцианы принимают участие в создании защитных механизмов растения от неблагоприятных условий. Мы уже говорили выше об участии этих невидимых флавоноидов в образовании лигнина. Так вот у хлопчатника, например, при засолении почвы лигнификация тканей стебля наступает гораздо быстрее, чем в обычных условиях. Лейкоантоцианы листьев при этом совместно с другими «заинтересованными» веществами «устремляются» к клеткам стебля, где в качестве строительного материала используются для образования сложных молекул полимера лигнина. Подобно бетону и железной арматуре в железобетонных конструкциях, лигнин и целлюлоза укрепляют клеточные оболочки и задерживают тем самым их рост и дальнейшее накопление в клетках избытка солей. У растений, не способных к быстрой лигнификации тканей (капуста, перилла), как показали исследования Б. П. Строганова и его сотрудников, лейкоантоцианы интенсивно накапливаются в листьях за счет использования промежуточных продуктов, образующихся при поглощении солей (особенно хлористого натрия). Лейкоантоцианы в данном случае как бы «предупреждают» возможность скопления ядовитых солей в клетках, ставят на пути их своеобразный «заслон», используя сахара, органические кислоты, аминокислоты и другие продукты обмена веществ для построения собственных молекул. Содействуя усилению окислительных процессов, они как бы «поддерживают» растение в трудное для него время.
Интересные опыты по изучению защитного действия флавоноидов против одного из злейших вредителей дуба — дубовой листовой филлоксеры — были поставлены в Центральном ботаническом саду АН УССР (В. П. Петрова, Н. М. Березовская, 1974, 1977). В листьях дуба, как правило, содержится очень мало лейкоантоцианов. Искусственным путем подсадили личинки вредителя на различные виды этого дерева. Что же оказалось? В листьях дуба северного, например, где личинки не прижились, резко увеличивалось содержание лейкоантоцианов. Эти флавоноиды, находясь в клетках в самом ничтожном количестве, в ответ на появление филлоксеры быстро образуются и накапливаются в листовых тканях, создавая своеобразный барьер на пути вредителя.
Как Р-активные вещества, лейкоантоцианы в ряде случаев превосходят по своему действию на организм человека общепризнанные катехины чайного растения, о которых наш рассказ еще впереди.
Какие же растения могут служить источником лейкоантоцианов? В первую очередь — плодово-ягодные. Весьма богаты этими флавоноидами некоторые сорта облепихи, хорошо прижившиеся в условиях Минска: Алтайская (257 мг*%), Дар Катуни (242 мг %), Новость Алтая (214 мг %) и другие (А. А. Чаховский и др., 1976). Высоким содержанием лейкоантоцианов, по данным лаборатории химии растений ЦБС АН БССР, обладают плоды боярышников, накапливающие от 400 до 1200 мг этих соединений в расчете на 100 г плодов.
На III Всесоюзном семинаре по биоактивным веществам плодов и ягод (Свердловск, 1966 г.) Л. И. Вигоров обратил внимание его участников на тот факт, что за счет лейкоантоцианов, которые в то время многими исследователями еще не принимались в расчет при оценке Р-витаминности плодов, ценность крыжовников, содержащих немного других биофлавоноидов, обычно удваивается (по сравнению с теми цифрами, что приводились обычно в научной литературе без учета содержания лейкоантоцианов). Содержание их в плодах крыжовника нередко превышает количество катехинов и флавонолов.
Исследуя сорта и гибриды белорусского винограда, мы обнаружили, что по содержанию лейкоантоцианов (определяемых совместно с катехинами) в неантоциановой группе выделяются Ольга и Юбиляр, накапливающие в кожице и мякоти ягод до 127 и 77 мг*% этих веществ соответственно. Общее содержание Р-активных флавоноидов у них в расчете на одну ягоду составляет около 1,3 мг. Эти сорта отличаются минимальным горошением ягод и сравнительно быстрым созреванием урожая (до 15 сентября). В антоциановой группе винограда богаты лейкоантоцианами ягоды гибрида № 1 Филиппенко (225 мг*%). Общее содержание Р-активных соединений в данном случае представлено в основном только этими соединениями. Заметим, что в семенах всех исследованных нами сортов и гибридов винограда лейкоантоцианов (совместно с катехинами) накапливается гораздо больше, чем в мякоти и кожице.
В дополнение к другим биологически активным флавоноидам лейкоантоцианы являются хорошими «помощниками» в создании Р-витаминного комплекса у многих кормовых злаков пойменных лугов. По нашим определениям, среди растений пойменного травостоя на первое место в этом отношении выходит бекмания обыкновенная (21 мг*% в расчете на сухой вес). Второе место занимают мятлики луговой и болотный, лисохвост луговой, полевица собачья, овсяница луговая, накапливающие в зеленой массе 12-16 мг*% (на сухой вес) этих флавоноидов.
Таким образом, отсутствие антоциановой окраски у стеблей, листьев, цветков и плодов вовсе не свидетельствует об отсутствии в них Р-активных флавоноидов. Очень часто здесь сосредоточиваются бесцветные, незримые лейкоантоцианы. В первую очередь это касается зеленоплодных крыжовника, винограда, смородины, сливы, яблони и других садовых растений.
Но, несмотря на свою невидимость, растительные «хамелеоны» этих культур всегда начеку. Они всегда на страже здоровья человека и в любое время готовы обнаружить свое присутствие, как это произошло в опытах их первооткрывателя — замечательного русского ученого Михаила Семеновича Цвета.
Загадочный комплекс катехинов
Молвит яблоко: «Поверьте,
всем краса моя мила,
За красу — мудрецами
мне возносится хвала,
Я при пиршествах веселых —
украшение стола,
Боль из сердца изгоняю,
если страсть кого сожгла».
Гарсеван Чолокашвили
Разная награда за одинаковые заслуги. — Дружба, но только в молодости, — Загадочный комплекс и его расшифровка. — Новорожденные покидают колыбель, — Какие листочки нужны чаеводам? — Две стороны одной медали -Дыхание «про запас»? — Слагаемые аромата и вкуса. — Почему не все яблоки темнеют на срезе? — Какой чай полезнее? — Яблоки против гипертонии.
Удивительная и непохожая судьба выпала на долю двух издавна хорошо известных растений — чая и яблони. Молодые побеги первого из них и плоды второго обладают способностью быстро накапливать катехины — капилляроукрепляющие флавоноиды, которые нормализуют работу сердца и почек. «Кто не испытал этого благодетельного напитка на себе!.. — восклицает в одном из своих трактатов русский офицер и ученый-этнограф, первым из европейцев исследовавший глубины Африки, Егор Петрович Ковалевский. — Стоит только выпить 2-3 чашки чая, чтобы снова ожить и быть способным продолжать путь…» Лингвист по образованию, но путешественник по призванию, Е. П. Ковалевский объехал Алтай и Урал, Африку и Китай, исследовал и описал природу и быт многих стран и народов. И всюду верным спутником был ему обыкновенный черный чай, выручавший и в жару, и в холод.
Ничего не зная о катехинах чая, люди издавна использовали их благотворные качества, культивировали чайное растение в самых тепличных условиях, терпеливо отбирали и размножали те экземпляры растений, листья которых давали наиболее терпкий и ароматный напиток, т. е. содержали больше катехинов. Сейчас хорошо известно, что еще задолго до появления всходов чайного растения его органы уже четко разделились на «главные» и «второстепенные» по способности образовывать и накапливать катехины: больше всего этих веществ синтезируется в молодых листочках, а в «появившихся надземных стеблях их в 15 раз больше, чем в корнях» (К. М. Джемухадзе, 1976).
Ничего не зная о катехинах яблок, люди очень долго и не стремились узнать о них, потребляя яблоки в значительных количествах в тех странах и регионах, где они растут. «При ежегодном урожае плодов около 4 млн. т мы получаем 4 тыс. т катехинов и лейкоантоцианов, что эквивалентно годичному обеспечению 100 млн. человек профилактическими дозами этих Р-активных соединений». Так говорил Л. И. Вигоров в декабре 1966 г. с трибуны I Всесоюзного симпозиума по фенольным соединениям (г. Москва). Ученый установил, что катехины начинают формироваться в яблоках на самых ранних этапах развития плодов. «Маленькие яблочки, образовавшиеся вскоре после цветения, — докладывал он в сентябре 1963 г. на II Всесоюзном семинаре по биоактивным веществам плодов и ягод, — уже содержат разнообразные катехины и нередко отличаются терпким вкусом».
Удивительная и непохожая судьба выпала чайному растению и яблоне. За одни и те же достоинства люди боготворили чайный куст, холили и лелеяли его, создавая ему все возможные и невозможные условия для расселения на нашей планете. Две крупные научные экспедиции были организованы в 80-90-х годах прошлого столетия в Индию, Японию, Китай и на о. Цейлон, чтобы детально изучить возможности поселения чайного растения в Крыму и на Кавказе. Только после долгой и кропотливой исследовательской работы чай появился на Черноморском побережье Кавказа нашей страны.
А что же яблоня? За такие же достоинства многие экземпляры этого растения с высоким содержанием катехинов в яблоках в течение многих десятилетий… уничтожались. Человек отбирал только те из них, плоды которых обладали приятным кисловато-сладким вкусом и имели на изломе белый цвет, подобный цвету ломтя свежеиспеченной булки. Растения же с терпкими на вкус плодами выбраковывались и отбрасывались. Так в течение длительного времени яблоки, главное достоинство которых оценивалось по сахаро-кислотному показателю, попадали в немилость, а вместе с ними — и катехины, очень нужные организму человека. Впрочем, так не могло продолжаться бесконечно. В 1956 г. Л. И. Вигоров и обратил на это внимание селекционеров.
Цену яблоку он знал с детства, поскольку прошел хорошую школу садоводства в Минусинске, в саду своего отца, одного из пионеров сибирского садоводства Ивана Прохоровича Бедро, где уже в 13-летнем возрасте был автором ряда гибридов яблони. За сравнительно короткий промежуток времени Леонид Иванович сделал совместно с небольшой группой своих сотрудников-энтузиастов настоящий переворот в садоводстве. К скромной по штату и оборудованию первой в стране лаборатории биологически активных веществ плодов и ягод (г. Свердловск) протянулись незримые нити со всех концов нашей страны: там родилось новое направление в биохимии растений — лечебное садоводство. О катехинах яблок Л. И. Вигоров сказал очень много, по разработанной им методике началась массовая инвентаризация на катехины (и другие Р-активные флавоноиды) огромного сортимента плодово-ягодных растений в нашей стране и за рубежом.
Что же представляют собой катехины растений? Сколько их существует, где они накапливаются и какова их роль в растительном организме?
Как уже говорилось выше, катехины — это наиболее восстановленная группа флавоноидов. Свое название они получили по наименованию индийской акации катеху, в древесине которой эти вещества были впервые обнаружены еще в 1821 г. немецким биохимиком Ф. Рунге.
Акация катеху — это невысокое сильно ветвящееся дерево, имеющее твердую темно-бурую древесину. Население Индии издавна умело приготавливать экстракт из древесины катеху, измельчая и вываривая ее с водой. После процеживания, выпаривания до густоты и высушивания на солнце этот отвар применялся в качестве вяжущего средства внутрь, а также как наружное для примочек (Д. А. Муравьева, А. Ф. Гаммерман, 1974). Туземное население и сейчас широко использует его как жевательную массу под названием «бетель». Основное содержимое отвара из катеху — концентрат катехинов в комплексе с другими веществами.
Строение молекулы катехинов установили сотрудники Гейдельбергского университета (Германия) К. Фройденберг, Г. Фикенчер, М. Хардер и О. Шмидт в 1925 г. Пространственное же размещение атомов в молекуле катехинов удалось расшифровать только в 50-х годах нашего столетия.
Наиболее изучены в настоящее время два представителя этих флавоноидов: катехин и галлокатехин. Оба они обладают способностью присоединять (предположительно при помощи ферментов гидролаз) у третьего углеродного атома остаток галловой кислоты — галлоил. В результате образуются сложные эфиры (так называемые галлоилсоединения), которые именуются соответственно катехингаллатами и галлокатехингаллатами (рис. 11).
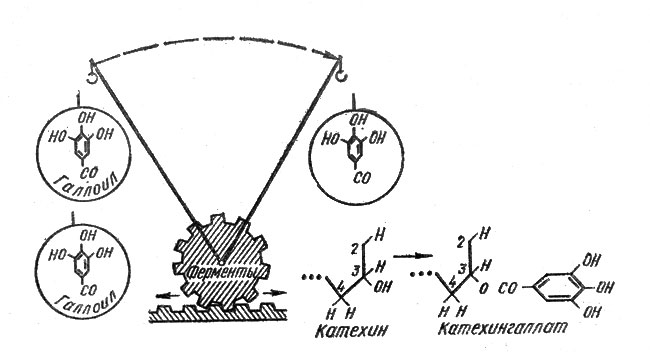
Рис. 11. Схема присоединения остатков галловой кислоты (под действием ферментов) к молекулам простых катехинов
Галлирование катехинов — характерная их особенность. М. Н. Запрометов указывает, что процесс этот протекает последовательно: сначала образуются более простые катехины, а затем, по мере их накопления и одновременного биосинтеза галловой кислоты, начинается галлирование. Заметим попутно, что галлированные катехины под действием фермента танназы обладают способностью к обратимому отщеплению от своих молекул остатков галловой кислоты и превращению в простые.
Явления эти наиболее полно изучены на примере чайного растения. Складывается впечатление, что галловая кислота в молодых листьях чая как бы «подстерегает» простые катехины (только что образовавшиеся), чтобы соединиться с ними, пока листочек еще молод. Замечено, что по мере старения листовых пластинок процесс галлирования ослабевает: в старых листьях чая свободной галловой кислоты обнаруживается уже в 3 раза больше, чем связанной с катехинами. Содружество этих веществ, таким образом, характерно только для молодых листочков чая — так называемых флешей.
Следует отметить, что катехины всегда обнаруживаются в растениях в изомерной форме, т. е. кольцо Б их молекул (рис. 1) может иметь как прямое, так и зеркальное пространственное изображение. В соответствии с этим катехины обозначаются со знаком «плюс» (прямое изображение) и со знаком «минус» (зеркальное изображение). Биохимики о таких соединениях говорят как о веществах D-формы (правой) и L-формы (левой), точно так, как ботаники обозначают одни и те же виды растений, но обладающие способностью поворачивать листья в правую или левую сторону.
Отметим, что «правое» и «левое» весьма широко распространено в растительном мире. В естественной обстановке растения обычно не «любят» симметрии. Никогда не совпадают, например, по конфигурации правая и левая половинки листа — одна из них всегда развита сильнее другой. Несимметрично расположены по отношению друг к другу попарно растущие хвоинки сосны: они обязательно закручены в виде спирали, чаще всего — в левую сторону. Атомы, из которых построена молекула растительного белка, всегда «закручены» также влево. Молекулы большинства природных сахаров пространственным расположением своих атомов повернуты в правую сторону.
Этому всеобщему закону поворачиваться в правую или левую сторону, закону, во многом еще не объясненному биологической наукой, подчинено и строение молекул катехинов. Они имеют два асимметричных атома углерода (2-й и 3-й), вокруг которых кольцо Б и другие связанные с ним атомы могут быть повернуты в правую или левую сторону. Отсюда и наличие катехинов D- и L-формы. Заметим, что сок из древесины акации катеху, давший название этим флавоноидам, в настоящее время хорошо изучен. Он состоит из L-эпикатехина, L-катехина, D, L-эпикатехина и D, L-катехина.
Комплекс катехинов чайного растения длительное время оставался загадкой. В суммарном виде он назывался и нередко теперь еще называется комплексом дубильных веществ (чайный танин). Разделить его на составные части долго не удавалось, хотя такие попытки предпринимались неоднократно. Во второй половине XIX века немецкий ученый Г. Хлазевитц выделил из листьев чая два фенольных соединения, одно из которых оказалось галловой кислотой, а второе — кверцетином (о нем мы будем говорить дальше). В 20-30-х годах нашего столетия японская исследовательница М. Цуджимура получила из зеленого чая три кристаллических катехина. В 40-х годах английским биохимикам А. Бредфилду и Е. Бейт-Смиту удалось выделить уже семь различных катехинов. Эти ученые впервые доказали, что комплекс дубильных веществ чайного листа — это комплекс катехинов.
Подлинного же успеха в расшифровке этого комплекса добились советские ученые. В 30-х годах группе сотрудников Института биохимии имени А. Н. Баха АН СССР (г. Москва) было поручено обстоятельно изучить биохимический состав чайного растения в целях создания отечественной чайной промышленности. Возглавил эту группу старший научный сотрудник Андрей Львович Курсанов (ныне всемирно известный ученый директор Института физиологии растений имени К. А. Тимирязева АН СССР, академик, член академии наук ряда стран).

Рис. 12. Кристалы L-эпигаллокатехингаллата при увеличении в 100 раз (по A. Л. Курсанову и М. Н. Запрометову)
В результате кропотливой работы на чайных плантациях и фабриках Грузии был установлен ряд принципиально важных положений, позволивших создать стройную теорию чайного производства и культуры чая в стране. А. Л. Курсанов и его сотрудник М. Н. Запрометов впервые полностью расшифровали комплекс катехинов чайного растения, который, как выяснилось, состоит из восьми компонентов. В этом комплексе по количественному составу ведущее место принадлежит галлированным катехинам L-эпигаллокатехингаллату (58,1 %) и L-эпикатехингаллату (18,1 %). Они представляют собой кристаллы, имеющие вид длинных игл (рис. 12), растворимых в воде, спирте, ацетоне и не растворимых в бензоле и хлороформе. Простых катехинов в комплексе чайного танина значительно меньше: 12 % приходится на долю L-эпигаллокатехина и 0,4-2% — на долю D, L-катехина, L-эпикатехина и D, L-галлокатехина. Кристаллизуются эти вещества чаще всего в виде крупных игл или разнообразных геометрических фигур (рис. 13).
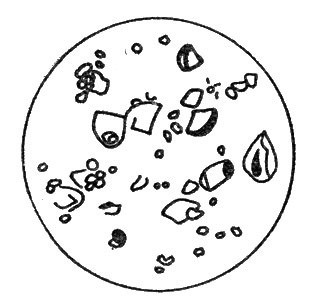
Рис. 13. Кристаллы D, L-галлокатехина при увеличении в 60 раз (по А. Л. Курсанову и М. Н. Запрометову)
В 60-х годах на примере катехинов чайного растения М. Н. Запрометовым и его сотрудницами С. В. Колонковой и В. Я. Бухлаевой впервые была установлена возможность образования фенольных соединений в хлоропластах — мельчайших органоидах клетки, в которых осуществляется фотосинтез.
Тем самым было серьезно поколеблено мнение о фенольных соединениях как о веществах вторичного происхождения, не имеющих никакого отношения к продуктам важнейшего процесса на, Земле — фотосинтеза, Выяснилось, что катехины чайного растения довольно быстро образуются в процессе фотосинтеза: через 30 минут после выдерживания на свету молодых веточек чая в атмосфере углекислого газа с радиоактивным (меченым) углеродом 26 % последнего уже обнаруживается в составе катехинов. Это в основном L-формы простых и галлированных катехинов с преобладанием первых из них.
Словом, чайное растение уже с самого начала появления на свет обеспечивает себя не только наиболее подвижными продуктами типа растворимых углеводов, но и довольно быстро накапливает катехины. Количество их стоит на втором месте после сахаров и значительно превышает содержание таких хорошо известных и жизненно необходимых веществ, как белки, аминокислоты, хлорофилл, каротиноиды, органические кислоты и др. Характерно, что простые катехины образуются непосредственно в хлоропластах, но там не накапливаются и не подвергаются галлированию. Остатки галловой кислоты они присоединяют вне хлоропластов, т. е. уже с самого момента своего образования катехины покидают хлоропласт — место своего «рождения» — и быстро включаются в обменные процессы растительного организма.
По исследованиям М. Н. Запрометова (1964), больше всего расходуется поглощаемого углекислого газа на образование катехинов в самом молодом — верхушечном — листе и верхушечной почке чая. По мере роста первый лист постепенно становится вторым, затем — третьим, а из верхушечной почки каждый раз развивается новый первый листочек. Таким образом, основной «кладовой» катехинов, как указывает М. Н. Запрометов, являются вторые и третьи листья растущих побегов чая. К. М. Джемухадзе и Ф. Г. Нахмедов (1966) впервые расшифровали качественный состав катехинов в свежесобранных флешах чайного растения. Они выяснили, что 1-2-дневная верхушечная почка и первые — третьи листочки содержат L-формы эпикатехина, эпигаллокатехина, эпикатехингаллата и эпигаллокатехингаллата, т. е. флеши «начинены» только левыми (простыми и галлированными) катехинами. Правые же формы простых катехинов обнаруживаются, как правило, в более старых и менее ценных листьях. Иногда они присутствуют и в молодых листочках, но редко и в меньших количествах. По-видимому, простые и галлированные катехины в L-форме имеют важное значение в обмене веществ молодых быстрорастущих первых — третьих листочков чайного растения. Именно эти листочки и собирают чаеводы.
Кто проезжал вдоль многочисленных чайных плантаций Грузии, тот не раз любовался быстрой ювелирной работой пальцев у сборщиков чайного листа. Тысячи едва уловимых для глаза движений пальцами за смену производят сборщики чая, и каждое движение рассчитано с максимальной точностью: отрываются только первые три листочка, богатые катехинами. Какими-то волшебниками из другого мира предстают всякий раз изумленному взору туристов эти люди, производящие тончайшую работу под палящими лучами южного солнца — молча, сосредоточенно, целеустремленно. А главное — точно и безошибочно.
Только ли на свету образуются катехины? Оказывается, нет. При перенесении молодых побегов чая в темноту процесс биосинтеза этих флавоноидов продолжается, правда, уже гораздо медленнее. Примерно в течение трех часов, находясь в темноте, молодые листочки продолжают синтезировать катехины, при этом на их образование расходуются сахара, накопленные в результате осуществления процесса фотосинтеза. Растение тратит на эту работу около 80 % образовавшихся ранее сахаров и в первую очередь — сахарозу, фруктозу, глюкозу.
Образование катехинов в процессе фотосинтеза, включение углекислого газа в состав молекул этих флавоноидов не могло не натолкнуть на мысль о близости их к универсальному процессу всех живых организмов — дыханию. Выше мы уже указывали, что дыхание обеспечивает энергией все жизненно важные участки клеток, тканей, органов, а без энергии невозможны рост, развитие и размножение организмов. По современным представлениям, фотосинтез и дыхание — это две стороны одного и того же сложного процесса жизнеобеспечения всех зеленых растений. Промежуточные и конечные продукты фотосинтеза являются исходными веществами для осуществления дыхательного процесса, и наоборот. Естественным поэтому было предположение о причастности катехинов (как продуктов фотосинтеза) к дыханию растений, к обеспечению клеток энергией за счет этих довольно активно образующихся флавоноидов.
Так оно и оказалось на самом деле. В 1959 г. в журнале «Доклады АН СССР» М. Н. Запрометов впервые сообщил о том, что чайное растение использует катехины в качестве дыхательного материала: радиоактивный углерод из молекул этих соединений, введенных в побеги, обнаруживался (через 60-70 часов после выдерживания их в темноте) уже в составе молекул «выдыхаемого» углекислого газа. При этом в течение первых часов растение как бы «робко» выделяет меченый углекислый газ — всего 5-10 % от введенного с катехинами углерода. Затем, через 20-30 часов, расход катехинов ускоряется и достигает 73-82 % от введенного их количества. Так было доказано участие этих флавоноидов в важнейшем процессе жизнедеятельности растений — дыхании.
Какой же биологический смысл заключен в этом факте? Зачем зеленому растению нужно тратить на дыхание катехины — эти сложные вещества, поддающиеся расщеплению гораздо труднее, чем более доступные углеводы?
Хорошо известно, что в процессе длительного эволюционного развития растения «научились» находить запасные пути для реализации своих жизненных запросов. Биологи называют их альтернативными (от латинского «альтернаре» — чередоваться), т. е. путями, попеременно чередующимися в зависимости от подходящих условий.
Использование катехинов в дыхании — один из примеров такого чередования различных путей добывания энергии. В обычных условиях растения дышат за счет окисления в основном углеводов, фонды которых постоянно пополняются за счет фотосинтеза — этого универсального процесса на Земле. Но вот из-за стечения неблагоприятных обстоятельств (например, наступления длительной темноты, похолодания и т. д.) запасы углеводов иссякли. В таких условиях растительный организм реализует один из имеющихся альтернативных путей обмена веществ, в данном случае — путь использования катехинов в качестве дыхательного материала. Вот почему листья чайного растения в первые часы пребывания в темноте «робко» выделяют углекислый газ, образующийся при окислении катехинов: в это время они имеют еще возможность расходовать на дыхание запасы углеводов, и только после израсходования этих запасов дыхание поддерживается за счет катехинов.
Словом, трудномобилизуемые в обычных условиях катехины растение использует, что называется, не от хорошей жизни: их оно как бы держит «про запас», «на черный день».
Как показали исследования Г. Б. Самородовой-Бианки и Г. М. Рыбак (1974), важное значение имеют катехины для дыхания яблок в процессе их хранения после съема. В этих условиях, когда температура воздуха снижена до 1,5-3°С, запасы углеводов, органических кислот и другого дыхательного материала в яблоках значительно уменьшаются, жизненные процессы тем не менее в них не останавливаются, жизнь в клетках яблок не замирает. Плоды используют для своего дыхания простые катехины, содержание которых в это время достаточно высоко. По мере прохождения срока хранения яблок эти катехины подвергаются окислительной конденсации, как это имеет место у лейкоантоцианов (об этом говорилось выше). В результате образуются димерные молекулы этих флавоноидов — так называемые конденсированные катехины. Эти соединения, так же как и простые катехины, до определенного времени (примерно до накопления их в количестве 120-140 мг на 100 г сырого веса) служат дыхательным материалом. Без дыхания нет жизни, дыхание — поставщик энергии.
Можно считать, что использование димерных катехинов для дыхания — проявление еще одного альтернативного пути в поддержании жизненного тонуса растительных клеток. Другими словами, при попадании в неблагоприятные условия клетки растительных органов и тканей (в данном случае — яблок) стремятся максимально использовать свои возможности для сохранения жизни. Катехины, как мы видим, активно помогают им реализовать эти возможности.
Словом, эти флавоноиды принимают активное участие в жизни растительного организма — и образуются, и используются они в наиболее важных жизненных центрах клеток.
Где же обнаруживаются обычно катехины в пределах растительной ткани? Л. И. Вигоров (1968) отмечал, что в яблоках, например, основная масса катехинов сосредоточивается в обкладочных клетках, вокруг жилок сосудисто-волокнистых пучков, в тонком слое мякоти, примыкающем непосредственно к кожице (в так называемой хлоренхиме), где сосредоточены хлоропласты, улавливающие энергию солнца для фотосинтеза. Короче говоря, катехины яблок обнаруживаются всегда там, где наиболее оживленно протекают основные жизненные процессы. Даже факт образования сложного комплекса катехинов — дубильных веществ — рассматривается в настоящее время как проявление активной жизненной функции у растительного организма. Дубильные вещества подвержены постоянным изменениям в количественном и качественном отношении: они распадаются на более простые составные части, которые вовлекаются в обмен веществ, и вновь синтезируются в отдельные периоды жизни растительного организма (В. М. Глезин, 1963). По наблюдениям Л. В. Поляковой (1973, 1974), у лиственницы сибирской наибольшее количество D-катехина и L-эпикатехина всегда обнаруживается в коре верхней части дерева, приближенной к кроне, а также на внутренней ее стороне, непосредственно примыкающей к клеткам камбия (быстро делящиеся клетки, благодаря чему дерево растет в толщину), т. е. в наиболее активных «центрах» растущего дерева. В коре лиственницы катехины накапливаются при условии хорошей освещенности деревьев, при наличии достаточного количества тепла и влаги. Засушливые же условия приводят к заметному снижению уровня этих флавоноидов.
Таким образом, только в условиях хорошей жизнеобеспеченности растений нормально функционируют процессы образования и использования катехинов. У чайного растения, например, они больше накапливаются (с одновременным повышением урожая листа), если на фоне фосфора и калия в почву вносились азотные удобрения (К. М. Джемухадзе, Т. С. Мгалоблишвили, 1966). Усиливается образование дубильных веществ и отдельных катехинов при поражении растений вирусными, грибковыми и бактериальными заболеваниями, в чем проявляется их защитная роль при поражении всевозможными инфекциями.
На способности молекул катехинов объединяться попарно в димеры основана современная технология чайного производства. Исследованиями А. Л. Курсанова, М. Н. Запрометова, М. А. Бокучава, К. М. Джемухадзе и других авторов установлено, что все внутренние биохимические процессы, протекающие в чайном листе при так называемой ферментации его на чайных фабриках, являются не чем иным, как окислительной конденсацией катехинов.
Чайный лист после сбора поступает на фабрику, где его завяливают в течение 6-8 часов, затем раздавливают на специальных скручивающих машинах на протяжении 2-3 часов, потом выдерживают от 2 до 5 часов при комнатной температуре в потоке кислорода. Что же происходит с катехинами чайного листа в результате такой обработки?
Под действием ферментов фенолаз, где ведущее место принадлежит полифенолоксидазе, катехины энергично окисляются, образуя массу димеров. В зависимости от продолжительности отдельных этапов ферментации и некоторых других факторов окисление катехинов может проходить до образования продуктов с различной степенью окисленности. В результате чайный танин, первоначально горький, постепенно теряет горечь и приобретает приятный, немного терпкий, но мягкий вкус. Образовавшиеся в огромном количестве красные и коричневые продукты окисления катехинов и других сопутствующих веществ придают чайному листу коричневый цвет (рис. 14). Настой из него имеет слегка вяжущий вкус и хорошо знакомый нам «чайный» аромат. Исследованиями М. А. Бокучава с сотрудниками было установлено, что в формировании аромата чая важное значение имеет взаимодействие катехинов с аминокислотами, в результате чего образуются альдегиды. Совместно с другими веществами чайного листа (флавонолами, летучими веществами, эфирным маслом и др.) они придают характерный для напитка аромат и вкус (букет черного чая).

Рис. 14. Изменение цвета чайного листа в результате окисления катехинов (по М. А. Бокучава)
Окисление комплекса катехинов, как доказали А. Л. Курсанов и М. Н. Запрометов, отличается от окисления каждого катехина в отдельности. В сложной смеси этих веществ при ферментации чайного листа значительно усиливаются так называемые вторичные реакции, в результате которых весь комплекс подвергается более глубокому окислению. Эти реакции осуществляются благодаря наличию L-эпикатехина и L-эпикатехингаллата, которые выступают в роли дополнительных ускорителей процесса ферментации. Своим присутствием они как бы заменяют действие ферментов, помогают чайному листу приобретать так полюбившийся нам приятный вкус и аромат чайного напитка.
Окислительная конденсация катехинов протекает не только в чайном листе. У яблок этот процесс люди наблюдали давно, только ничего не знали о сущности этого явления. Кто не видел, как некоторые яблоки на изломе приобретают бурую окраску, причем довольно быстро? Еще до недавнего времени в учебниках можно было встретить такое объяснение этому факту: в буреющих на воздухе яблоках содержится много железа. Это мнение глубоко укоренилось даже среди специалистов-технологов. На самом же деле яблоки буреют не от присутствия железа, а от окисления катехинов, которые под действием фермента полифенолоксидазы (ПФО) подвергаются глубоким превращениям, вплоть до образования коричневых флобафенов (от греческих «флокс» — пламя, «бафе» — окраска). В естественном состоянии клеток фермент и катехины пространственно разобщены, при разрыве же клеточных стенок (излом или разрез яблока) эти вещества соприкасаются, что ведет к окислению катехинов. Л. И. Вигоров (1964) указывал, что это явление характерно в особенности для мелкоплодных яблок, мякоть которых богата катехинами и ПФО. Он назвал возможные причины отсутствия побурения при нарушении целости яблока. Так, оно не наблюдается, во-первых, из-за незначительного содержания катехинов в мякоти; во-вторых, вследствие слабой активности ПФО; в-третьих, при сравнительно высоком содержании аскорбиновой кислоты, которая частично принимает на себя действие окислительных ферментов, превращаясь в дегидроаскорбиновую кислоту; в-четвертых, из-за неблагоприятных условий для деятельности ПФО ввиду наличия органических кислот в соке, которые «сдерживают» работу фермента.
В результате «лавинного» побурения мякоти, т. е. быстрого и массового образования флобафенов в яблоках, катехины могут почти целиком исчезнуть. Такой процесс особенно характерен при механических повреждениях мякоти, перезревании плодов, хранении яблок в подвале и т. д. Все эти факторы приводят к постепенному разрушению клеток, и фермент ПФО из цитоплазмы, где он обычно сосредоточен, свободно смешивается с клеточным соком, в котором растворены катехины.
Как же получить яблочный сок, не потеряв значительной части природных катехинов, если всякое механическое повреждение яблок сопряжено с окислением этих веществ? Л. И. Вигоров (1968) на основании многолетних кропотливых исследований рекомендовал отбирать плоды тех сортов, в мякоти которых достаточно высокое содержание простых (мономерных) катехинов сочетается со слабой активностью фермента полифенолоксидазы. Из уральских яблок такими качествами, например, обладают сорта Уралец, Октябрьское и некоторые другие. Ряд сортов (Луковка, Авангард и др.) накапливает катехины, устойчивые к окислению, а поэтому почти не теряет их в отличие от сортов, катехины которых почти полностью подвергаются окислительной конденсации (например, Китайка сахарная, Любимец).
Заметим, что с точки зрения химической все молекулы катехинов обладают невысокой устойчивостью, т. е. не существует устойчивых и неустойчивых катехинов. Но в клетках яблок (как и в других растительных тканях), где присутствуют вещества, препятствующие разрушению катехинов (витамин С, различные органические кислоты и др.), одни и те же катехины «ведут себя» неодинаково: некоторые из них обладают большей устойчивостью, некоторые — меньшей. Поэтому употребляемые нами термины «устойчивые катехины» и «неустойчивые катехины» следует понимать с большой долей условности. Они лишь верно отражают суть дела с точки зрения биологической, но отнюдь не химической.
Побурение яблок вследствие окисления катехинов — процесс довольно сложный. В. Ф. Демьянец и Г. М. Рыбак (1974) указывают, что он сопровождается в ряде случаев окислением еще одного фенольного соединения — хлорогеновой кислоты (о ней мы уже говорили выше) и протекает параллельно со скоростью падения ее количества и одновременного накопления конденсированных катехинов.
Каким же способом выявить сорта яблок с «устойчивыми» к окислению катехинами? Л. И. Вигоров предложил простой метод, заключающийся в следующем.
Из свежих яблок отжимается сок и выдерживается в течение суток на воздухе. В зависимости от интенсивности образования флобафенов (а следовательно, и степени разрушения катехинов) сок приобретает различную окраску. Если она черно-коричневая, то это свидетельствует о значительном окислении катехинов. Если же сок имеет бледно-желтый цвет или же почти бесцветен, то такие яблоки унаследовали свойство слабо окислять свои катехины. Окраска сока в желто-коричневый цвет указывает на «среднюю» окисляемость катехинов. Разумеется, для более точных сведений необходимо лабораторное определение количества хлорогеновой кислоты, активности фермента полифенолоксидазы.
На способности катехинов противостоять действию фермента ПФО основано использование их для повышения устойчивости антоцианов. Это особенно важно для сохранения красного цвета в продуктах переработки столовой свеклы. М. А. Бокучава и Г. Н. Пруидзе (1970) установили, что незначительная добавка препарата катехинов (40 мг в 1 л воды на 0,5 мг кашицы свеклы) полностью устраняет деятельность фермента и сохраняет антоцианы свеклы от разрушительного его действия как в обычных условиях, так и при повышенной температуре.
Природные катехины, таким образом, помогают сохранить продукт и позволяют заменить использовавшиеся ранее в этих целях некоторые синтетические красители, небезвредные для организма человека (например, амарант). При этом одновременно повышается Р-витаминная ценность продукта.
Как уже говорилось ранее, катехины проявляют высокую биологическую активность в организме человека и животных. Важную роль в установлении этой активности на примере чайного растения сыграли исследования Андрея Львовича Курсанова с сотрудниками. За эти работы он получил два авторских свидетельства на изобретения (1952 и 1958 гг.), а также Диплом на открытие (1961 г.). Дальнейшими исследованиями (А. Л. Курсанов, М. Н. Запрометов, В. Н. Букин, К. Л. Поволоцкая, Н. Н. Ерофеева) было установлено, что катехины по своему Р-витаминному действию превосходят все применявшиеся ранее препараты аналогичного назначения. Наиболее активным компонентом этих флавоноидов, выделенных из чайного листа, оказался эпикатехин. На основании клинических испытаний А. Л. Курсанов и М. Н. Запрометов разработали технологию получения Р-витаминного препарата катехинов из отходов чайного производства. По этой технологии с 1954 г. на Щелковском витаминном заводе был начат выпуск комплекса чайных катехинов. В виде таблеток эти флавоноиды затем начали производить совместно с аскорбиновой кислотой. С витамином С выпускается сейчас и другой препарат — аскорутин (аскорбиновая кислота + рутин, относящийся к флавонолам. О флавонолах речь будет идти дальше).
Чайный куст — первое растение, в котором было обстоятельно изучено образование и накопление катехинов. Из чайного листа в настоящее время вырабатываются различные типы чая, имеющего ценность благодаря содержащимся в нем катехинам. Исследованиями М. А. Бокучава с сотрудниками доказано, что наибольшую Р-витаминную ценность имеет зеленый байховый чай, на втором месте стоит черный байховый, на третьем — зеленый плиточный чай. Промежуточное положение между черным и зеленым чаем по содержанию катехинов занимает красный (оолонг) и желтый чай. Р-витаминное действие чая в целом определяется, как указывает М. А. Бокучава (1958), не общим количеством содержащихся в нем катехинов, а их качественным составом и степенью окисленности. Чем больше в чае неокисленных катехинов (что характерно, как мы видели, и для яблок), тем выше его Р-витаминная активность. Заметим, что в формировании Р-витаминной ценности чайного листа принимают участие также флавонолы и флавоны. Однако о них речь будет идти в следующей главе.
Чайный напиток с его целебными катехинами насколько древний, настолько и молодой. Технология получения чая постоянно совершенствуется и обновляется, загадочный комплекс катехинов его все полнее и полнее раскрывает свои таинства. На ряде чайных фабрик внедрен сейчас новый способ получения черного чая, предложенный Институтом биохимии имени А. Н. Баха АН СССР. Он заключается в неполной сушке листа после операции скручивания (до остаточной влажности 6-10 %), в результате чего в полуфабрикате сохраняется больше катехинов, чем при обработке по обычной, общепринятой технологии. После сушки продукт подвергается воздействию постоянной температуры (50-65 °С) в течение 2-5 часов.
Такая термическая обработка чайного листа, у которого практически не закончилась еще ферментация, обеспечивает значительное сохранение катехинов в готовом продукте, чем улучшается качество чая, повышается его Р-витаминная ценность. В таком чае практически полностью сохраняется весь качественный состав катехинов, характерный для зеленого листа. В количественном отношении черный чай содержит примерно третью часть катехинов, имеющихся в исходном сырье (М. А. Бокучава и др., 1968). Чашка чайного напитка, приготовленного из черного чая, полученного по новой технологии, содержит суточную норму катехинов (около 25 мг). В сухом продукте их содержится от 30 до 70 мг в расчете на 1 г веса. Заметим, что в 1 г обычного черного чая имеются только следы катехинов.
В последние годы специалисты Института биохимии имени А. Н. Баха АН СССР, Всесоюзного НИИ чайной промышленности и Института биохимии АН ГрузССР совместно с научно-производственным объединением «Чайпром» и п/о «Грузия-чай» под руководством профессора М. А. Бокучава разработали технологию производства быстрорастворимого зеленого и черного чая. Сырьем для его получения служат низкосортные листья и формовочный материал, который накапливается при подрезке и формовке кустов. Раньше он просто оставался на плантации и не использовался в чайном производстве, а сейчас нашел применение как источник Р-активных катехинов, содержание которых в одном грамме сухого концентрата достигает от 200 до 400 мг.
Из половины грамма растворимого чая получается стакан напитка с приятным, терпким вкусом. Приготавливается напиток быстро, подобно тому как чашка растворимого кофе.
Чайные катехины вызвали к жизни редчайшую в настоящее время профессию — титестера (от латинских «теа» — чай, «тест» — оценка). Так называются люди, оценивающие цвет, аромат и вкус чайного напитка. Они дают так называемую полевую оценку чая в зависимости от условий его выращивания, погоды, размещения чайных шпалер и т. д. Титестеры — это, как правило, женщины с весьма острым обонянием. Они выпивают большое количество самого разнообразного чая, чтобы дать объективную оценку ему по аромату, вкусу, примерному содержанию Р-активных катехинов. Эти люди годами шлифуют свое профессиональное мастерство, не применяют косметических средств, не употребляют других напитков. Без титестеров не обходится сейчас ни одна чаеразвесочная фабрика.
Чайный лист, этот древний источник чудесного напитка, таит в себе еще много неиспользованных возможностей. Не исключено, что в будущем человек поставит на службу своему здоровью практически все катехины этого растения, напиток из которого так высоко ценил в свое время генерал-лейтенант Корпуса горных инженеров, неутомимый путешественник Егор Петрович Ковалевский.
Заметим, что содержащиеся совместно с катехинами флавонолы и флавоны представляют собой ничтожное меньшинство, поэтому, говоря о ценности чайного листа, мы имеем прежде всего в виду катехиновый комплекс этого растения.
Важное значение для здоровья человека имеют фрукты и ягоды, содержащие достаточное количество катехинов. Л. И. Вигоров подчеркивал, например, что яблоки как источник Р-активных катехинов представляют особую ценность, поскольку катехины их не сопровождаются, как в чае, кофеином и теобромином, способствующими расширению сосудов головного мозга. Несмотря на то что в чае кофеин обнаружен еще в 1827, а теобромин — в 1871 г., потребность в этих алкалоидах организма человека медициной пока не установлена.
В лечебных целях действие катехинов яблок изучалось клинически. К. Н. Пасынкова (1964) приводит результаты амбулаторного лечения больных гипертонической болезнью различного возраста (от 20 до 52 лет) и давности заболевания от 2 до 8 лет.
Больным давали уральские яблоки (Китайка абрикосовая, Вкусное, Филипповка и Ветлужанка) с содержанием катехинов 300-600 мг на 100 г сырого веса. Длительность лечения составляла 10-25 дней, в течение которых больные принимали ежесуточно 400 г яблочного пюре одновременно с остальной пищей. Что же выяснилось?
У 9 из 14 больных уже в конце первой недели лечения артериальное давление крови снижалось до нормы и в таком состоянии оставалось на протяжении месяца после лечения (дальнейшие наблюдения не проводились). Одновременно со снижением кровяного давления исчезали боли в области головы и сердца, улучшался сон, в подавляющем большинстве случаев уменьшалось содержание холестерина в крови. Характерно, что при лечении яблоками ни разу не отмечено возникновение побочных неблагоприятных явлений.
Л. И. Вигоров на I Всесоюзном симпозиуме по фенольным соединениям в декабре 1966 г. указывал, что при использовании в сутки 300 г яблок с высоким содержанием катехинов (в виде компота или варенья) у больных гипертонией нормализовались кровяное давление и протромбиновый индекс быстрее, чем при лечении препаратами папаверином и диуретином. Нормализованное состояние обычно сохранялось дольше, чем при использовании обычных лечебных средств.
Какие же яблоки богаты катехинами?
Л. И. Вигоров (1961) обнаружил, что наибольшим содержанием катехинов отличаются мелкоплодные сорта, в частности Ранет пурпуровый (660 мг*%), Филипповка (550 мг*%), Любимец (400 мг*%), Аниснк омский и Желтое наливное (380 мг*%), Китайка уральская (340 мг*%), Гриднева, Комета, Ударница, Малютка и Пониклое (310-330 мг*%). Из крупноплодных сортов выделяются Ароматно-восковое и Щедрое (340 мг*%), Анисы алый, золотистый и пурпуровый (230-280 мг*%). Меньше катехинов накапливают Белый налив и Папировка (150 мг*%), а также Боровинка обыкновенная (200 мг*%).
По исследованиям лаборатории химии растений Центрального ботанического сада АН БССР (А. А. Чаховский и др., 1976), богаты катехинами, кроме яблони, и другие представители семейства розоцветных, в частности боярышники, о целебном действии плодов которых сообщал еще знаменитый врач древности Диоскорид. Особенно много катехинов накапливают плоды боярышников однопестичного, пятипестичного, колючего, Ливони, Факсона, шамплейского (от 1200 до 1700 мг*% на сырой вес мякоти). В целом содержание катехинов в плодах большинства видов этого растения всегда достаточно высокое и колеблется в пределах 300-800 мг*%.
Широко распространена в Белоруссии рябина обыкновенная. Ее можно встретить в садах и парках, вдоль железных и шоссейных дорог, у подъездов домов. Кто не любовался в начале осени яркими красно-оранжевыми плодами этого одного из самых «песенных» деревьев нашей страны? Ажурная крона, множество щитков с нарядными плодами выделяют рябину из окружающей ее среды. Многие деревья стоят уже без листьев, голые и сиротливые, и на их фоне рябина еще больше привлекает богатством своих красок.
Но не только красотою и нарядностью выделяется рябина. По содержанию Р-активных веществ в плодах она занимает ведущее положение среди плодово-ягодных растений. Из этих веществ главное место принадлежит катехинам, которые представлены в основном наиболее биологически активным L-эпикатехином. В целом на каждые 100 г плодов рябина обыкновенная накапливает от 240 до 370 мг*% катехинов (А. А. Чаховский и др., 1976).
Из дикорастущих ягод лесов Белоруссии, как указывает Г. В. Сенчук (1973), наиболее богата катехинами брусника (434 мг*%). Эти вещества в зрелых ягодах представлены исключительно L-эпикатехингаллатом. До 352 мг*% этих флавоноидов накапливается в зрелой клюкве, до 286 мг*% — в чернике и голубике. Следует отметить, что наиболее физиологически активный L-эпикатехин широко представлен в ягодах черники, голубики и клюквы различной зрелости и совершенно отсутствует в бруснике.
Важным средством сохранения природных Р-активных веществ явилась разработка способов комплексного использования плодово-ягодного сырья методом купажирования (от французского «купаж» — вмешивание) соков из различных плодов и ягод (Д. К. Шапиро и др., 1965-1972). Тем самым создаются продукты с заранее запрограммированным количеством биологически активных флавоноидов и других полезных для здоровья веществ. Разработанные белорусскими биохимиками купажированные чернично-черносмородиновый и голубично-черносмородиновый соки с сахаром содержат соответственно 86 и 140 мг*% катехинов.
Перспективной оказалась полная или частичная замена воды соками высоковитаминных плодов и ягод при изготовлении различных сиропов. Например, производство компота из ягод красной смородины на черносмородиновом сиропе (вместо воды) позволило довести содержание катехинов в нем до 125 мг*% при сохранении других полезных веществ. По разработанным рецептам выпускаются различные соки, сочетающие в себе наиболее ценные качества исходного сырья. Так, яблочно-черноплоднорябиновый сок сочетает в себе катехиновую ценность яблок и антоциановые достоинства аронии, а рябиново-яблочный сок заключает в себе катехиновые достоинства обоих растений в сочетании с каротином (провитамин Л), флавонолами и флавонами плодов рябины обыкновенной.
Таким образом, индийская акация катеху, из древесины которой был получен впервые сгущенный сок (сок «пегу-катеху») с высоким содержанием катехинов, не только дала название этой группе флавоноидов. Она послужила толчком к довольно плодотворным поискам катехинов в других растениях и плодах, в результате чего установлена была «катехиновая» сущность чайного листа, а также различных сортов яблок.
Катехины яблок, так долго остававшиеся вне поля зрения селекционеров, усилиями сотрудников лаборатории биологически активных веществ плодов и ягод Уральского лесотехнического института во главе с профессором Л. И. Вигоровым постепенно начинают занимать причитающееся им по праву почетное место в профилактике ряда недугов.
Мы многое сейчас знаем о катехинах чая и плодово-ягодных растений. Не исключено, что в ближайшем будущем мы узнаем о них еще больше. Возможно, загадочный комплекс катехинов откроет нам еще не одну свою тайну, особенно среди фруктовых растений. «Фрукты — это величайшие защитники нашего здоровья, — писал Леонид Иванович Вигоров. — Несомненно, что они будут занимать все более видное место в числе основных мероприятий по предупреждению различных заболеваний».
Большая «семья» флавонолов и флавонов
Говорят, очам полезно
видеть желтое — ах, где же
Кипарис в одеждах розы,
что пылает желтым жаром?
Алишер Навои
Чем «пылят» растения? — Вещества оплодотворения? — Имена дают растения. — Не распаханное до конца поле. — Кто любит свет, а кто лишь темноту. — Сглаженная конкуренция. — Химическая прополка и флавоновые вещества. — «Пиррова победа»? — Флавонолы, флавоны и рост. — Защитники сильного. — Чем «плачут» березы? Вместе с известным витамином. — Желтая аптека.
Прогуливаясь в конце весны по сосновому лесу, присмотритесь к его внутреннему миру. Ваше внимание обязательно привлечет не только живительный смолистый аромат и приглушенный шелест разлапистых веток с их многочисленными хвоинками, — листочками. В эту пору года вы не можете не заметить обилия золотисто-желтой пыльцы, туманной завесой обволакивающей деревья. Сосновый лес «пылит». Ветер разносит пылинки на большие расстояния и производит опыление женских шишечек сосны, при этом пыльца одних деревьев попадает на шишечки других. Пылит, впрочем, не только сосна. Пылят многие деревья и кустарники, пылят травянистые растения. Если же ко времени вашего посещения леса прошел хотя бы небольшой дождь, заполнивший разъезженную колею лесной дороги лужицами воды, вы непременно обнаружите на их поверхности тончайшую пленку, сверкающую желтизной, — массовое скопление цветочной пыльцы, сбитой дождевыми каплями. Покрывая близлежащие водоемы, она служит отменным лакомством для мальков рыб.
Величайший знаток природы и тонкий пейзажист М. М. Пришвин в одной из своих зарисовок серии «Времена года» на сей счет подметил: «Пыльца цветущих растений так засыпала лесную речку, что в ней перестали отражаться береговое высокие деревья и облака». Что это: пример крайне высокой расточительности и «бесхозяйственности» в природе? Оказывается, ни то, ни другое. Это один из способов гарантии оплодотворения. Растения щедро расходуют свои пластические вещества, чтобы наверняка обеспечить зарождение новой жизни.
В процессе длительного развития растительного мира в природе сложилась и прижилась большая группа растений с самыми необыкновенными приспособлениями, препятствующими опылению собственной пыльцой (самоопылению). Они называются перекрестноопыляемыми. Сейчас хорошо известно, что только от перекрестного опыления, когда на рыльца пестиков попадает не своя, а чужая пыльца (при помощи ветра, насекомых), формируются наиболее крепкие и здоровые семена, дающие потомство таких организмов, которые способны противостоять различным жизненным невзгодам.
Природа оказалась щедрой на «выдумки», чтобы воспрепятствовать прорастанию собственной пыльцы на рыльце пестика у таких растений. Среди множества всевозможных препятствий к самоопылению у одних и тех же видов известно явление гетеростилии (от греческих «гетерос» — различный, «стилос» — столб) — разностолбчатости цветков. Заключается оно в том, что часть экземпляров одного и того же вида имеет длинные столбики пестиков, в результате чего они возвышаются над тычинками, а часть — короткие, спрятанные под собственные тычинки. Такая разностолбчатость не позволяет пыльце попадать на рыльце пестика с этого же цветка. Это явление характерно для гречихи, первоцвета, незабудки и ряда других растений. Опыление у них, как и у сосны, носит перекрестный характер. Прорастает у разностолбчатых растений только та пыльца, которая попала с тычинок короткостолбчатых цветков на рыльца пестиков длинностолбчатых. А если все же пыльца с тычинок одного вида цветков попадет на пестик того же самого (например, длинностолбчатого) вида? Она просто не прорастет и пылинки не дадут те живительные слизистые ниточки- трубочки, по которым содержимое их перетекает через столбик пестика в его завязь. Зарождение новой жизни не наступит. Почему?
Немецкий ученый Ф. Мевус (1953) определил, что пыльца короткостолбчатых и длинностолбчатых цветков содержит в себе гликозиды флавоноидов желтого цвета, отличающиеся друг от друга только остатками сахара, присоединенными к одному и тому же агликону — кверцетину. Он обратил внимание на тот факт, что в пыльце короткостолбчатых цветков находится кверцетин-3-рутинозид (рутин), а в пыльце длинностолбчатых — кверцетин-3-рамнозид (кверцитрин). Ученый предположил, что в момент готовности к оплодотворению, когда рыльца пестиков становятся влажными и «ждут» пыльцу, у короткостолбчатых цветков вырабатывается фермент, способный расщеплять только кверцитрин, у длинностолбчатых — только рутин. Тем самым рыльца пестиков короткостолбчатых цветков обеспечивают прорастание пыльцы только с тычинок длинностолбчатых цветков, и наоборот.
Это один из биологических механизмов, сложившихся в природе в течение миллионов лет, обеспечивающий жизненную несовместимость однотипных цветков и исключающий самоопыление у перекрестноопыляемых растений. Как видим, ведущая роль в этом механизме принадлежит желтым флавоноидам, получившим название флавонолов (от латинского «флавус» — желтый). Забегая вперед, отметим, что пыльца всех без исключения растений богата флавонолами, а также флавонами, которые совместно с каротином и другими каротиноидами придают ей золотисто-желтый цвет. И хотя в пыльниках тычинок вырабатывается огромное количество пыльцы, рассеиваемой в окружающее пространство (природа щедро «позаботилась» о будущем потомстве), соответствующие пылинки будут встречены пестиками только «подходящих» цветков. Большая «заслуга» в обеспечении такой жизненной совместимости принадлежит флавоновым веществам.
Советский биохимик С. И. Пашкарь (1970) определил, что у кукурузы на рыльцах пестиков еще задолго до встречи их с пыльцой образуется большое количество фенольных соединений. Через два часа после соприкосновения пылинок с рыльцем пестика обнаруживается усиленный полифенольный обмен, сопровождающийся повышением активности ферментов полифенолоксидазы и пероксидазы. Важную роль в этом обмене играют флавоноловые гликозиды, в частности гликозиды кверцетина и мирицетина. Особенно высоким содержанием их отличаются метелки кукурузы. Подчеркивая сложность процесса оплодотворения, С. И. Пашкарь отмечает, что в вопросах его регуляции, в «работе» по подготовке мужских и женских половых клеток к слиянию особая роль принадлежит флавоноловым гликозидам. Он называет их «веществами оплодотворения». К числу таких веществ в первую очередь относятся те флавонолы, которые имеют в своих молекулах метильные группы СН3 (например, изорамнетин и его производные).
Обсуждая роль флавонолов в половом процессе растений, B. Г. Минаева (1978) замечает, что эти флавоноиды выполняют неодинаковые функции в различных участках женской части цветка — гинеция. Так, в рыльцах пестиков и стенках завязей володушки, т. е. участках, обеспечивающих прорастание пыльцы и рост пыльцевых трубок, ведущее значение при оплодотворении принадлежит процессам распада флавонолов под действием ферментов. Каков же биологический смысл этого распада?
А смысл его заключается в освобождении сахаров, связанных с агликонами флавонолов, чтобы обеспечить питанием растущие пыльцевые трубки. В. Г. Минаева, так же как и C. И. Пашкарь, отмечает преимущественное накопление во всех частях цветка изорамнетина и его производных по сравнению о другими флавонолами. В частности, содержание его в ряду частей обвертки — лепестки — тычинки — пестики нарастает с одновременным падением содержания кверцетина и его производных. А если взять только пестик, то относительное содержание изорамнетина у него нарастает от рыльца к семяпочке (рис. 15). Автор полагает, что в процессе оплодотворения изорамнетин и его производные являются донорами метильных групп СН3, которые используются затем в качестве «строительного материала» для формирования молекул пектиновых веществ, служащих «каркасом» в оболочках растущих пыльцевых трубок.
Рис. 15. Распределение изорамнетина в различных частях пестика володушки (по данным В. Г. Минаевой): 1 — рыльце; 2 — столбик; 3 — завязь
К флавонолам близко по своим свойствам примыкают флавоны. Это два наиболее обширных семейства флавоноидных соединений, которые с давних пор использовал человек в качестве природных красителей. М. Н. Запрометов (1974) отмечает, что первое из них объединяет в своем составе одних только агликонов около 70 штук, второе — свыше 40. Каждый агликон имеет собственное наименование. Основных агликонов в семействе флавонолов четыре: кверцетин, кемпферол, изорамнетин и мирицетин. Отличаются они друг от друга количеством групп ОН в боковом кольце молекулы. Кемпферол имеет одну такую группу, кверцетин — две, мирицетин — три. У изорамнетина, как уже говорилось выше, одна из двух групп ОН метилирована, т. е. атом водорода ее замещен группой СН3 (метил).
В семействе флавонов основных агликонов три: апигенин (имеет одну группу ОН в боковом кольце), лютеолин (две ОН-группы) и трицин (одна группа ОН и две — ОСН3).
Из флавонолов наиболее распространен в растительном мире кверцетин, выделенный впервые из коры дуба, за что и получил свое название (дуб по-латыни «кверкус»). Значительные количества его концентрируются в листьях винограда, конского каштана, клевера, гречихи, ясеня, хлопчатника, ряда садовых культур (боярышников, слив, груш и др.). Накапливается кверцетин как в виде агликона, так и в виде различных гликозидов. Мы уже упоминали о гликозидах кверцетина — рутине и кверцитрине. Первый из них распространен широко, но особенно много его в пыльце и лепестках. По этому гликозиду, обнаруженному впервые еще в 1842 г. в растениях руты (за что он и получил свое название), часто судят о широте «расселения» флавонолов по растительному миру. Он служит эталоном при количественных определениях этой группы флавоноидов в растительных тканях и органах.
Нахождение флавонолов и флавонов в виде гликозидов — характернейшая их особенность, сахарные остатки (чаще всего глюкозы, галактозы и рамнозы) присоединяются у 3-го углеродного атома, замещая атом водорода. В зависимости от растения, из которого были впервые выделены эти гликозиды, они и получили соответствующее название. Например, гиперин (кверцетин+сахар галактоза) был обнаружен первоначально в листьях зверобоя (по-латыни «гиперикум перфоратум»); астрагалин (кемпферол + глюкоза) — в цветках астрагала, трицин — в листьях пшеницы (по-латыни «тритикум») и т. д. Способность агликонов флавонолов и флавонов к массовому образованию гликозидов свидетельствует о высокой их активности.
А. П. Волынец и В. М. Кудрявцева (1978) нашли в пыльце и рыльцах пестиков тюльпанов огромные скопления флавоноловых гликозидов, которые они классифицировали на 5 групп. Весь фенольный комплекс пыльцы, по их наблюдениям, представлен в основном различными по своей структуре гликозидами кверцетина, кемпферола и изорамнетина, при этом отмечены весьма существенные различия в составе флавонолов у отдельных частей цветка. Например, моногликозиды флавонолов «заселяют» только пылинки тычинок, ди- и тригликозиды обнаруживаются лишь в пыльце, а дигликозиды, содержащие сахара монозу и биозу, находятся обычно в рыльцах пестиков. Авторы обоснованно предполагают, что каждой из обнаруженных групп флавонолов отводится «персональная» роль в опылении и оплодотворении. Характерно, что в рыльцах пестиков флавоноловых гликозидов содержится, как правило, в 3-4 раза меньше, чем в пыльце.
Сформировавшиеся молекулы гликозидов флавонолов и флавонов очень часто не остаются в неизменном виде. Они вступают в реакции ацилирования, т. е. присоединения остатков кислот. Об этих реакциях мы уже говорили при рассмотрении антоцианов и катехинов. Как и катехины, флавонолы, например, довольно «охотно» присоединяют ацилы. Разница только в том, что катехины «стремятся к захвату» остатков галловой кислоты, относящейся к так называемому ряду оксибензойных кислот (или С6-C1-соединений), в результате чего образуются, как мы уже говорили, галлированные катехины.
Флавонолы же «предпочитают» оксикоричные кислоты (С6-С3-соединения), и в первую очередь — паракумаровую кислоту. Они присоединяют эту кислоту (при участии ферментов) к остатку глюкозы у 3-го углеродного атома (рис. 16). Присоединив, например, остаток паракумаровой кислоты, глюкозид кемпферола превращается в вещество, известное под названием тилирозида. Содержится оно в цветках липы (по-латыни «тилиа»). В лепестках петунии обнаружен петунозид ацилированный (при помощи остатка феруловой кислоты) дигликозид кемпферола.
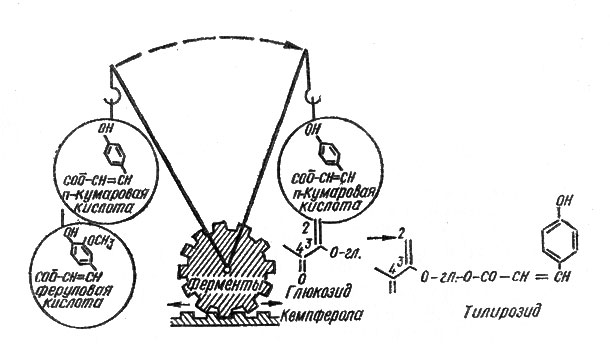
Рис. 16. Схема присоединения остатков оксикоричных кислот к молекулам флавоноловых гликозидов
Большое внимание физиологов и биохимиков растений в последнее время привлек ацилированный тригликозид кверцетина, который получил название кверцетин-гликозил-кумарата (КГК). Его выделили из гороха и описали свойства американские ученые Ф. Мамфорд, М. Фуруйя, А. Галстон, Б. Стоу, Д. Смит и Дж. Кэстл. Это было в начале 60-х гг. нашего века. О свойствах КГК и причине пристального к нему внимания мы скажем чуть ниже. Теперь лишь подчеркнем, что возможности для открытия все новых и новых флавоноловых гликозидов практически неограничены. В 1968 г. советские физиологи растений В. И. Кефели и P. X. Турецкая сообщили о весьма похожем на КГК соединении, которое они выделили из листьев салата.
Флавонолы и флавоны — поистине участок поля, далеко еще не полностью распаханного. Известный английский биохимик Дж. Харборн в своей книге «Сравнительная биохимия флавоноидов» (1967) подразделяет гликозиды одних только флавонолов на 48 классов, отмечая при этом, что число их еще не окончательно. Достаточно сказать, что эти соединения обнаружены в листьях свыше 70 % двудольных растений. В книге «Экстрактивные вещества древесины и их значение в целлюлозно-бумажном производстве» (1965), написанной группой крупнейших зарубежных специалистов, о флавонолах и флавонах говорится, что в растительном мире «более примечательным является их отсутствие, а не присутствие».
Нельзя не согласиться с этим, достаточно лишь вспомнить обилие золотисто-желтой пыльцы, вырабатываемой цветками и повсеместно распространяющейся в природе в таком количестве, что многие растения, как писал М. М. Пришвин, «пылят желтой мучницей».
На накопление флавонолов и флавонов в растениях оказывает влияние свет, его продолжительность и интенсивность.
Замечено, что свет необходим для образования всех флавоноидов, имеющих в положении 3 (см. рис. 1) группу ОН. Среди флавонолов этому условию соответствует кверцетин, среди флавонов — лютеолин.
Действительно, при освещении растений красным и дальним красным светом повышается содержание не только антоцианов (об этом уже говорилось выше), но и гликозидов кверцетина. На комплекс же гликозидов кемпферола действие света не распространяется. Считается, что гликозиды кемпферола, накопившись в темноте, способны превращаться (при участии фитохрома) в соответствующие гликозиды кверцетина (рис. 17).
Рис. 17. Схема превращения гликозидов кемпферола в гликозиды кверцетина с участием фитохрома
Заметим, что система «кверцетин — кемпферол» очень часто обнаруживает свое присутствие в растительном мире. Вообще действие света на образование флавонолов и флавонов настолько специфично, что малейшая недостаточность в освещении растений резко отрицательно сказывается как на биосинтезе этих флавоноидов, так и на формировании тычинок. Так, у четырех видов кормового растения борщевика недостаток света приводил к очень слабому образованию флавоновых веществ в листьях и цветках и одновременно вызывал ряд нарушений в цветении (Д. Д. Басаргин, П. Г. Горовой, 1975). Образовавшиеся тычинки сразу же после распускания цветков опадали, а ряд соцветий (преимущественно боковых) вообще не получал развития.
Регулируется образование флавонолов и флавонов также и некоторыми другими факторами. Изучая вопросы накопления флавоновых веществ в зеленой массе горца забайкальского — перспективного для Белоруссии кормового растения, — мы обратили внимание на тот факт, что минеральное питание в дозе 30 и 60 кг/га азота, фосфора и калия положительно сказывается на концентрации этих веществ в стеблях и листьях в течение всего периода вегетации (И. А. Карабанов, Л. И. Булавко, 1975). Характерно, что в листьях их обнаруживается (в расчете на сухой вес) гораздо больше, чем в стеблях, и уровень этот поддерживается в течение всего лета, что является косвенным подтверждением установленного факта образования флавоноидов в процессе фотосинтеза.
Ранее мы говорили, что биосинтез флавоноидов ослабляется под действием азота, поскольку в растениях конкурируют за общий предшественник — аминокислоту фенилаланин — две системы: белкового и фенольного синтеза. В наших же опытах в период нарастания зеленой массы (а нарастает она у горца довольно быстро) минеральное питание усиливает образование флавоновых веществ как в листьях, так и в стеблях. Мы объясняем это эффективным использованием растениями основных элементов питания на сравнительно бедной ими дерново-подзолистой почве. Вместе с общей активизацией ростовых и других жизненно важных процессов (в том числе и синтеза белка) активизируются одновременно и те ферментные системы, которые принимают участие в формировании молекул флавоноидов. У. В. Маргна (1972) указывает, что эти системы имеют исключительно высокую работоспособность даже в самых неблагоприятных условиях (например, в условиях усиленного «захвата» фенилаланина для построения белковых молекул). Характерно, что в фазе цветения, когда особенно усиливается полифенольный обмен, под влиянием минерального питания в стеблях и листьях горца заметнее возрастат содержание наиболее окисленных флавоноидов — флавонолов, чем лейкоантоцианов.
Мы объясняем это усилением в растениях окислительных процессов благодаря преобладанию в почве ионов, способствующих реакциям окисления (O-3, Н2РО-4, Сl-) и внесенных туда вместе с содержащими их удобрениями — аммиачной селитрой, суперфосфатом и хлористым калием. Применение сбалансированного минерального питания, таким образом, дает возможность в какой-то мере сгладить конкурентные отношения между процессами биосинтеза белка и накоплением флавоновых веществ, обеспечить более высокий уровень их в зеленой массе ценного кормового растения.
Серьезная перестройка в комплексе флавоновых соединений и в фенольном обмене растений вообще происходит при обработке посевов гербицидами (от латинских «герба» — трава, «цедере» — убивать), т. е. веществами, уничтожающими сорную растительность. Обстоятельные исследования в этом направлении провел в Белоруссии А. П. Волынец вместе со своими сотрудниками и учениками (А. П. Волынец, 1974; Н. А. Ламан, 1970; С. М. Маштаков и др., 1971). Как же «ведут себя» флавонолы под влиянием химической прополки посевов?
В молодых растениях люпина и льна-долгунца под действием невысоких доз 2,4-Д, 2М-4Х (средства против двудольных сорняков) количество флавонолов возрастает в течение длительного отрезка времени. При этом активность роста растений в незначительной мере повышается. Иное действие оказывают более высокие дозы этих гербицидов, а также другие средства уничтожения сорной растительности в посевах — трихлоруксусная кислота (ТХА) и далапон. Не вдаваясь в ряд деталей множественного действия химических средств прополки посевов (что не входит в задачу нашего рассказа), отметим только, что высокие, «гербицидные» нормы указанных веществ вместе с уничтожением сорняков приводят к резкому нарушению фенольного состава культурных растений.
Особенно изменчивой оказалась группа флавонолов. Количество их в растительных органах уменьшается, при этом возрастает содержание более простых фенолов типа оксикоричных кислот (о которых речь шла уже выше), появляются новые фенолы, не свойственные растениям в обычных условиях. Характерно при этом, что количество широко распространенных в растительном мире ароматических аминокислот фенилаланина и тирозина, за «перехват» которых соревнуются биосинтез белка и биосинтез фенолов (рис. 4), уменьшается с одновременным подавлением белкового синтеза. В этом соревновании, таким образом, побеждают фенолы. Но какие и какой ценой? Ведь содержание флавонолов — этой обширной группы флавоноидов — уменьшается. Выходит, «пиррова победа»? Фенолы победили, но ценой флавонолов?
Оказывается, гербициды подавляют у культурных растений (более отчетливо — у чувствительных сортов, менее — у устойчивых) один из путей образования флавоноидов, а именно ацетатно-малонатный путь, который ведет к формированию кольца А их молекул. Одновременно усиливается деятельность второго — шикиматного — пути, благодаря которому формируется боковое кольцо Б (рис. 1). В результате такой внутренней перестройки путей биосинтеза фенольных соединений сложные молекулы флавоноидов (и в первую очередь — флавонолов) оказываются не в состоянии собрать свой «каркас», поскольку не хватает «строительного материала». Поэтому действие гербицидов и приводит к накоплению в культурных растениях более простых фенольных соединений, которые являются, как установлено, тормозителями роста. Их принято называть «фенольными ингибиторами» (от латинского «ингибире» — задерживать). Наиболее сильное ингибирующее действие на рост оказывают салициловая, паракумаровая и некоторые другие кислоты.
К фенольным ингибиторам роста относятся не только вещества с простейшей структурой молекул. В значительной мере тормозят ростовые процессы и некоторые флавоноиды, в частности флавонолы кверцетин и кемпферол. Их тормозящее действие четко прослеживается на работе хлоропластов — этих мельчайших клеточных органоидов, в которых происходит уникальный «космический» (по выражению К. А. Тимирязева) процесс использования солнечной энергии для окисления воды и восстановления углекислого газа в сложные органические вещества. А. П. Волынец и Р. А. Прохорчик (1973, 1978) определили, что если к выделенным из зеленого листа хлоропластам добавить незначительное количество кверцетина или его гликозида рутина, то отчетливо обнаруживается угнетающее действие этих веществ на нормальную работу хлоропластов. В чем оно заключается? Хлоропласт в введенными в него флавонолами медленнее и в меньшей мере выделяет кислород: флавонолы тормозят процесс разложения воды, протекающей в обычных условиях под действием поглощаемой солнечной энергии. Подсчитано, что деятельность хлоропластов подавляется наполовину. Присутствие в этих органоидах кверцетина ослабляет также процесс фотосинтетического фосфорилирования, т. е. образование при фотосинтезе веществ, богатых энергией.
По современным представлениям, фотосинтез — это беспрерывный поток электронов в зеленом листе от возбужденного светом хлорофилла через ряд промежуточных веществ-переносчиков на углекислый газ, который проникает в лист через микроскопические устьица-щели. Четкая и слаженная работа всех звеньев этой системы обеспечивает постоянство потока электронов. Нарушить его могут различные внутренние и внешние факторы. Накапливаясь в значительных количествах, флавонолы оттягивают на себя часть электронов, не давая возможности им нормально проходить по привычному пути, выработанному природой в течение многих лет. По данным Р. А. Прохорчик и А. П. Волынца, ингибирующая активность флавоноидов (и флавонолов в том числе) в этом отношении тем выше, чем больше в их молекулах групп ОН.
Таким образом, под действием флавонолов фотосинтез протекает менее продуктивно, что отрицательно сказывается на росте. Характерно, что видимому замедлению ростового процесса всегда предшествует накопление заметных количеств фенольных ингибиторов (в том числе и флавонолов). Хорошо это или вредно для растений?
Отметим, что деятельность ингибиторов роста — нормальное явление в мире растений. В жизни каждого растительного организма есть немало моментов, когда усиление ростового процесса нежелательно и даже вредно (например, осенью, при подготовке к зиме). В такое время и срабатывает система внутренней авторегуляции, в осуществлении которой принимают участие флавонолы и флавоны. Особенно сильным ингибиторным действием на рост обладает КГК — связанная с глюкозой форма кверцетина и паракумаровой кислоты. Об этом веществе мы уже говорили несколько выше. Подчеркнем сейчас, что именно благодаря своим ингибиторным свойствам оно и привлекает в последнее время внимание ученых. В системе внутренней авторегуляции ростового процесса КГК принадлежит важная роль. Замечено, что этот ацилированный флавонол образуется в клетках на самых ранних этапах роста. Его накопление продолжается по мере нарастания массы растительного организма и достигает максимума ко времени цветения. Другими словами, флавоноловый ингибитор функционирует во время самого активного роста. Не парадокс ли это? Что же он в таком случае ингибирует?
Оказывается, действие этого вещества носит сложный и своеобразный характер. Известно, что в растительном организме существует сложная система внутренней регуляции роста с помощью различных групп физиологически активных соединений: 1) гормональная (при участии растительных гормонов типа ауксинов, гиббереллинов, цитокининов, абсцизовой кислоты и этилена) и 2) негормональная (при участии витаминов, фенольных соединений и некоторых других веществ). О силе и направленности действия (ускорение или ослабление роста) того или иного регулирующего вещества судят обычно по прибавке в росте отрезков колеоптиле (первый лист, образующийся при прорастании злаков). Эти отрезки культивируют в растворе с добавлением изучаемого вещества в течение определенного времени. Таким способом в отношении КГК установили, что это вещество в дозе 2 мг и более на 1 л воды угнетает рост отрезков колеоптиле пшеницы на 40-50 % (Н. Н. Чумаковский, 1968). Паракумаровая кислота такое же действие оказывает, будучи испытанной в меньших дозах (0,5-1 мг на 1 л воды). Оба эти соединения снимают стимулирующее действие гиббереллинов — фитогормонов, сильно ускоряющих обычно рост стебля. Таким образом, и паракумаровая кислота, и КГК проявляют некоторое сходство в тормозящем влиянии на рост.
Однако в их «поведении» обнаружены и существенные различия: паракумаровая кислота ослабляет стимулирующее влияние на рост ауксинов, КГК же в присутствии этих фитогормонов не ослабляет рост, но даже проявляет с ними в какой-то мере синергизм, т. е. «помогает» им осуществлять стимуляцию ростового процесса. Почему? Дело в том, что КГК подавляет действие фермента ауксиноксидазы и тем самым предохраняет ауксины от окисления, которое осуществляется обычно с участием этого фермента. Вот почему ауксины в присутствии КГК увереннее «чувствуют себя» и более продуктивно выполняют свои функции по поддержанию и ускорению ростового процесса.
Так флавоноловый ингибитор КГК оказывается в роли не тормозителя, а ускорителя роста. Такое действие его усиливается еще и тем, что он «невольно» в какой-то мере выключает работу другого сильного ингибитора — паракумаровой кислоты. Ведь для образования его молекул эта кислота нужна как «строительный материал»: совместно с кверцетином и глюкозой она связывается в единый комплекс — молекулу КГК. Характерно, что у карликовых форм гороха этот флавонол накапливается в больших количествах, чем у обычных (В. И. Кефели и др., 1973). Высокое его содержание обнаруживается в листьях гороха, салата при воздействии яркого света, тормозящего рост. Количество ауксинов при этом резко падает.
Флавонолам принадлежит важная роль в защите растений от болезней и вредителей. Выше мы говорили уже об опытах с пересадкой дубовой листовой филлоксеры на листья различных видов дуба. Фенольные соединения этого растения представлены в основном флавонолами. Вспомним, что название одного из них, наиболее распространенного, — кверцетина происходит от латинского наименования дуба (кверкус). В естественных условиях не все виды дуба поражаются филлоксерой. Этот вредитель не приживается, например, на листьях дуба северного, черешчатого и двуцветного.
Как же реагируют устойчивые виды этого дерева на искусственную подсадку к ним яиц и личинок листовой филлоксеры?
Дуб северный сразу же «не принял» вредителя, дуб черешчатый «терпел» его только в течение двух недель, а затем отверг. На дубе двуцветном филлоксера вначале прижилась и была отторгнута лишь через некоторое время. Таким образом, ни один из этих видов дуба «не принял» вредителя. В обычных условиях, когда эти виды дуба живут без вредителя, в их листьях содержится сравнительно небольшое количество флавонолов. Не исключено, что они вовлекаются в общий обмен веществ и помогают поддерживать жизненный тонус организма на более высоком уровне. С подсадкой вредителя содержание флавонолов в листовых тканях возрастает: растения мгновенно создают какой-то барьер на пути филлоксеры.
Возможно, что это явление и не служит еще доказательством защитного действия флавонолов от филлоксеры, однако наличие какой-то связи между накоплением в клетках этих соединений и отторжением вредителя несомненно.
Любопытные сведения о защитной роли флавонолов и флавонов получены в Институте биоорганической химии АН СССР (Г. П. Кононенко и др., 1975; С. А. Поправко, 1976). Из зимующих почек березы бородавчатой было выделено несколько флавонолов и флавонов, которые способны подавлять рост колеоптиле пшеницы, т. е. являются фенольными ингибиторами. Накапливаясь обычно ко времени наступления зимы, они обеспечивают задержку ростовых процессов и переход деревьев в состояние покоя.
Но вот наступает весна, и березовые почки оживают. Кто бывал в это время в березовой роще, тот не мог не наблюдать выпадение на землю смолисто-янтарных капелек, слегка липких и сладковато-терпких на вкус. Пронизанные солнечными лучами, литые, сверкающие, выкатываются они из распускающихся почек мелкими слезинками. Березы «плачут».
Явление это известно людям давно, но только теперь выяснилось, что в березовых «слезах» и почках находятся те же флавонолы и флавоны, что и в пчелином клее — прополисе (от греческих «про» — раньше, перед, «полис» — город), при помощи которого эти удивительные насекомые прикрепляют восковые крышечки, закрывающие вход в их «город»-соты. Характерно, что и в березовых почках, и в прополисе флановолы и флавоны содержатся примерно в одинаковых соотношениях: об этом, по-видимому, позаботились пчелы — эти неутомимые труженики природы. Прополис обладает чудесными бактерицидными свойствами: в летний зной, когда для развития бактерий наступают самые благоприятные условия, пчелиный улей представляет собой эталон стерильной чистоты. От проникновения туда микробов он надежно защищен природными флавонолами, флавонами и другими близкородственными веществами, содержащимися в прополисе. Подсчитано, что до 150 г из одного улья собирают пчеловоды полезного человеку клея за сезон, и в каждом его грамме содержатся березовые «слезы», обладающие целебными свойствами.
Поистине неисчерпаема кладовая природы! Не зря любители русской бани предпочитают березовый веник всем другим, особенно при ощутимой ломоте в пояснице, насморке, кашле: флавонолы и флавоны его листьев совместно с другими Р-активными веществами и щедрым жаром парилки укрепляют стенки кровеносных сосудов, оказывают благотворное действие па кровообращение организма, возвращают человеку бодрость и здоровье.
Выше мы уже упоминали о «содружестве» всем известного витамина С (аскорбиновой кислоты) и лейкоантоцианов, которые предохраняют его от окисления и потери витаминных качеств. Выяснилось, что подобными свойствами обладают и флавонолы.
Впервые о взаимосвязанном влиянии витамина С и Р-активных флавоноидов на организм человека и животных сообщили еще в 1938 г. венгерские биохимики А. Сцент-Дьердьи и Л. Висбери. Позже были получены данные о стабилизирующем действии некоторых флавоноидов (в том числе флавонолов и флавонов) на аскорбиновую кислоту и в растительных организмах. Удобным объектом изучения этого их свойства явилась черная смородина, известная как хороший С-витаминоноситель.
Г. Б. Самородова-Бианки (1965) проследила за накоплением витамина С и флавонолов в ягодах ряда сортов этого растения. Что же выяснилось? По мере роста и созревания ягод увеличение абсолютного количества аскорбиновой кислоты в них сопровождается энергичным накоплением флавонолов: кверцетина, кемпферола, мирицетина. Особенно благоприятным сочетанием этих веществ отличаются сорта европейского подвида черной смородины (100 мг % флавонолов и 190 мг % витамина С).
На чем же основано такое «содружество» флавонолов и этого известного витамина? Оказывается, опять-таки… на ингибиторных свойствах флавонолов: они ослабляют работу фермента аскорбиноксидазы, который обычно ускоряет окисление витамина С. Наиболее сильным «укрощающим» действием на этот фермент обладает кверцетин (Г. Б. Самородова-Бианки, Г. Стенлид, 1968). Механизм такого действия флавонолов объясняется способностью их образовывать комплексные соединения с ионами металлов, в частности с медью, а также защитным действием флавонолов. Медь входит составной частью в активный центр фермента аскорбиноксидазы. Связываясь через нее как через своеобразный «мостик» в единый комплекс с ферментом, флавонолы «отключают» его от активной работы по окислению витамина. Так по цепочке прослеживаются истоки взаимодействия флавонолов и широко распространенного в растительном мире витамина С, взаимодействия, в основе которого лежат антиокислительные (антиоксидантные) свойства флавонолов. На этих свойствах основано современное практическое использование этих флавоноидов (особенно их агликонов) в пищевой (плодоконсервной) промышленности для предохранения продуктов (в том числе и продуктов консервирования) от окисления, чем дольше сохраняется их качество. Флавонолы нашли практическое использование (совместно с катехинами и другими флавоноидами) в стабилизации пищевых жиров, в консервировании гранатов, яблок, винограда, груш, красной смородины, черники, голубики. Совместно с антоцианами флавоны и флавонолы используются в качестве красящих веществ в кондитерской промышленности.
Какие же растения являются наиболее богатыми по содержанию биологически активных флавонолов и флавонов — этого большого семейства фенольных соединений, которые присутствуют практически во всех частях растительного организма? Прежде чем говорить о природных источниках флавонолов и флавонов, отметим, что наибольшую популярность из этих веществ получил кверцетин и один из его гликозидов — рутин. Таблетки их можно приобрести сейчас в любой аптеке. Все они растительного происхождения, главным образом — из листьев гречихи. Впервые рутин был получен из этого растения еще в 1944 г. в США. М. Ф. Шахова (1959) указывает, что лучшими сортами гречихи по содержанию рутина являются Богатырь, Большевик, Красноуфимская и Епифанская (до 2880 мг % в расчете на сухой вес).
Сравнивая районированный в Белоруссии сорт гречихи Юбилейная 2 и близкородственное растение горец забайкальский по содержанию в их листьях флавоновых соединений (в расчете на рутин), мы обнаружили, что горец в этом отношении выгодно отличается от гречихи. Если листья гречихи (при выращивании ее в окрестности г. Гомеля) накапливают ко времени цветения 160 мг % этих веществ (в расчете на сырой вес), то листья горца — 300-321 мг % (И. А. Карабанов, Л. И. Булавко, 1975). Применение полного минерального питания в посевах по 30 и 60 кг/га азота, фосфора и калия позволяет повысить содержание флавоновых соединений в листьях горца до 420-540 мг % (в зависимости от условий года). Горец забайкальский на дерново-подзолистой супесчаной почве образует довольно высокий сомкнутый травостой, поэтому зеленая масса его с единицы площади дает гораздо больший выход флавоновых веществ, чем гречиха.
В качестве хорошего источника рутина зарекомендовала себя софора японская. Это бобовое древесное растение с большой развесистой кроной, хорошо известное в Японии, Китае, Корее. В нашей стране софору японскую используют для озеленения городов в южных районах (Ростовская область РСФСР, Украина, Молдавия и др.). Вот как описывает это дерево профессор С. И. Ивченко в своей «Книге о деревьях» (1973): «Внешне софора напоминает белую акацию и очень привлекательна, когда ее крона сплошь покрыта душистыми кремоватыми цветками. Цветки-мотыльки появляются на дереве дружно и недели через две так же дружно опадают, сплошь устилая землю. Их место занимают длинные клейкие зеленые плоды — бобы с небольшими, будто зерна мелкой фасоли, семенами».
В лепестках, цветочных бутонах, а также бобах софоры сконцентрировано громадное количество флавонолов и флавонов. Не зря наши предки издавна добывали из цветочных бутонов софоры японской стойкий желтый краситель. По данным М. Ф. Шаховой (1959), бобы софоры накапливают до 44000 мг % флавоновых веществ (в расчете на сухой вес). Примерно в два раза меньше обнаружено их в листьях эвкалипта.
И софора, и эвкалипт — эти рекордсмены по накоплению флавоновых соединений — теплолюбивые растения. А. В. Благовещенский (1966) отмечает, что наиболее богата флавоноловыми гликозидами растительность тропических и альпийских природных зон. Он объясняет такую приуроченность этих веществ важной ролью их как поглотителей ультрафиолетовой радиации, благодаря чему хлорофилл и цитоплазма клеток предохраняются от перегрева и разрушения. У эвкалипта, как известно, есть еще одно природное приспособление к предотвращению перегрева: его листья ориентированы по отношению к солнцу ребром своих пластинок, благодаря чему и флавоновые вещества, и хлорофилл их в наименьшей мере подвержены разрушению. Поэтому эвкалиптовое дерево и не дает тени: природа мудро распорядилась его достоинствами, отдав предпочтение целебным качествам эвкалиптового листа, а не роли его в создании тенистых мест под палящими лучами южного солнца.
Гликозидами кверцетина весьма богаты лепестки и семена хорошо известного своей декоративностью конского каштана обыкновенного. Невозможно не любоваться величавыми розовато-белыми с легкой желтизной свечами соцветий этого дерева! Красавцы-каштаны украшают улицы Москвы и Ужгорода, Гомеля и Одессы, Мозыря и Кишинева. Цветущая ветвь этого обильного своей зеленью растения заняла центральное место в гербе г. Киева. Но ценность каштана не только в его декоративной красоте. Созревшие его светло-коричневые семена, а также сухие листья, содержащие кверцетин, связанный с остатками глюкозы, арабинозы, рамнозы и других сахаров, экспортируются в зарубежные страны.
Богаты флавоновыми веществами сибирские и дальневосточные виды лекарственного растения володушки. Обстоятельные исследования в этом направлении проведены В. Г. Минаевой с сотрудниками (В. Г. Минаева, 1978). В результате этой работы выяснено, что листья, стебли и соцветия володушки накапливают кверцетин, изорамнетин, а также их гликозиды: изокверцитрин, рутин и изорамнетин-3-рутинозид. Последний особенно концентрируется в генеративных органах. В тычинках его содержание составляет около 74 %, в завязях пестиков достигает 85 % от общего количества флавонолов. Больше всего содержится флавонолов в соцветиях и листьях володушки — до 9352 мг % в расчете на абсолютно сухой вес.
Обилие флавоновых веществ в различных видах володушки послужило основанием для выделения из нее суммарного препарата этих флавоноидов, который был назван буплерином (от латинского названия володушки «буплеурум»), а его авторы В. Г. Минаева, К. А. Соболевская, Т. А. Волхонская, М. П. Малых и И. В. Ашихмина получили авторское свидетельство на изобретение (В. Г. Минаева, 1978).
Буплерин содержит в себе пять флавоноловых соединений, из которых 70 % (по весу) принадлежит изорамнетин-3-рутинозиду и около 25 % — рутину. Он испытывался в четырех клиниках страны (МГМИ имени Н. П. Пирогова, Глазная клиника Северо-Осетинского мединститута, Клиника глазных болезней имени В. П. Одинцова МГМИ имени И. М. Сеченова, кафедра детских болезней Новосибирского мединститута), в результате чего доказано, что препарат уменьшает проницаемость кровеносных капилляров при лечении сердечно-сосудистых заболеваний, снижает отек тканей сетчатки глаза, благоприятно действует при первичных атаках ревматизма, при острой пневмонии и остром нефрите у детей. Действие буплерина выражено сильнее при совместном применении его с витамином С. Эффективность препарата особенно проявилась при глазных операциях, где он в значительной мере уменьшает кровоизлияние как во время операции, так и в послеоперационный период.
Выше мы уже говорили о чайном растении и его катехинах, отмечали, что Р-витаминный комплекс его состоит не только из катехинов. В состав фенольных соединений чайного листа входят также гликозиды кемпферола, кверцетина и мирицетина. Характерной особенностью их, как указывают М. А. Бокучава с сотрудниками (1968), является высокая устойчивость к разрушению в процессе производства черного чая: около 80 % флавонолов, содержащихся в зеленом чайном листе, сохраняется в готовом продукте — черном байховом чае.
Флавоны апигенин и лютеолин в обильном количестве обнаруживаются совместно с кверцетином и его производными в растениях семейства сложноцветных, в частности в соцветиях и листьях пижмы обыкновенной (П. П. Хворост, 1968), в различных видах астрагала (австралийский, пушистоцветковый, новоасканийский, шерстистоцветковый), а также хорошо известной всем ряски, заполняющей своими маленькими листочками поверхность стоячих водоемов (П. Е. Кривенчук и др., 1968). Флавон трицин накапливается в листьях хлебных злаков (особенно в пшенице), в стеблях и листьях различных видов комнатного растения примулы (Дж. Харборн, Н. Симмондс, 1968).
Среди кормовых растений пойменного травостоя, по нашим исследованиям, накоплением флавоновых веществ выделяются (в расчете на сухой вес) овсяница луговая (300 мг %), полевица собачья (176 мг %), мятлик луговой и манник водяной (154 мг %). На втором месте по накоплению этих флавоноидов в зеленой массе стоят вейник длинный и тимофеевка луговая (до 114 мг %), на третьем — вейник наземный (98 мг %) и лисохвост луговой (80 мг %).
Высоким содержанием флавонолов и флавонов характеризуются многие плодово-ягодные растения. По данным Д. К. Шапиро с сотрудниками (1961), ягоды черной смородины, богатые антоцианами, содержат много и флавоновых веществ. Это в первую очередь такие сорта и гибриды ее, как Лошицкая (до 178 мг %), 4/9-Д (до 192 мг %) и 4/39 (до 220 мг %). Из косточковых пород по содержанию этих веществ выделяются плоды вишни сортов Гриот остгеймский (до 1105 мг %), Владимирская и Новодворская (до 192 мг %). По исследованиям лаборатории химии растений ЦБС АН БССР, много флавоновых веществ накапливается в мякоти плодов пятипестичного, алмаатинского, зеленомясного и колючего боярышников. Следует отметить, что плоды боярышников характеризуются высоким количеством и большим разнообразием флавонолов и флавонов в плодах. Большинство видов его содержит в расчете на сухой вес 200-330 мг % флавоновых веществ в плодах, а у таких сортов, как Приречный и Вееровидный, эти цифры достигают соответственно 665 и 623 мг % (В. П. Петрова, 1968). Наибольшее количество флавоновых соединений оказалось в мякоти плодов боярышника согнуточашечкового. В. С. Батюк и Д. Г. Колесников (1968) весь комплекс этих веществ разделили на 4 группы: кверцетина (гиперозид, кверцитрин, кверцетин), лютеолина (глюколютеолин), апигенина (космосиин, рамноапигенин) и группу С-гликозидов (кратенацин, дезацетилкратенацин).
Характеризуя эти данные, Л. И. Вигоров во вступительном докладе на IV Всесоюзном семинаре по биоактивным веществам плодов и ягод (г. Мичуринск, 1970 г.) с озабоченностью подчеркивал настоятельную необходимость фармакологических исследований крупноплодных и вкусных боярышников, таких, как холмовой, понтийский, Пояркова, Бреттшнейдера и другие, по их влиянию на сердечную деятельность. Он предсказывал, что близкие по качественному составу флавоновые вещества должны быть обнаружены в айве, груше и рябине.
В плодиках рябины обыкновенной содержится достаточно высокое количество флавоновых веществ — 246 мг % в расчете на сырой вес (А. А. Чаховский и др., 1976).
Словом, природная аптека из различных представителей большого семейства флавонолов и флавонов всюду окружает нас. Они не всегда так отчетливо видны, эти желтые флавоноиды, как это имеет место в лепестках анютиных глазок, плодах рябины или вокруг высохших весенних лужиц, где образуются золотистые обрамления из сбитой дождем пыльцы.
Но сопутствуют человеку флавонолы и флавоны повсеместно — в листьях, стеблях, цветках, плодах самых различных растений. Природа немыслима без этой желтой аптеки.
Литература
- Биохимия фенольных соединений (под редакцией Дж. Харборна). — М., Мир, 1968.
- Благовещенский А. В. Биохимическая эволюция цветковых растений (глава 5). — М., Наука, 1966.
- Бокучава М. А. Биохимические основны производства лао-ча и зеленого кирпичного чая. — М., Издательство АН СССР, 1955.
- Бокучава М. А. Биохимия чая и чайного производства. — М., Издательство АН СССР, 1958.
- Вигоров Л. И. Витамины на ветках. — Свердловск, Средне-Уральское книжное издательство, 1969.
- Вигоров Л. И. Сад лечебных культур. — Свердловск, Средне-Уральское книжное издательство, 1976.
- Витаминные ресурсы и их использование. — В сб.: Витамин Р — его свойства и применение. — М., Издательство АН СССР, 1959, № 4.
- Джемухадзе К. М. Культура чая в Демократической Республике Вьетнам. — М., Наука, 1976.
- Дурмишидзе С. В. Дубильные вещества и антоцианы виноградной лозы и вина. — М., Издательство АН СССР, 1955.
- Запрометов М. Н. Биохимия катехинов. — М., Наука, 1964.
- Запрометов М. Н. Основы биохимии фенольных соединений. — М., Высшая школа, 1974.
- Любименко В. Н., Бриллиант В. А. Окраска растений. Растительные пигменты. — Л., Государственное издательство, 1924.
- Маштаков С. М., Деева В. П., Волынец А. П., Прохорчик Р. А., Щербаков В. А., Кудрявцев Г. П. Физиологическое действие некоторых гербицидов на растения. — Минск, Наука и техника, 1971.
- Минаева В. Г. Флавоноиды в онтогенезе растений и их практическое использование. — Новосибирск, Наука, 1978.
- М. И. Нейштадт. Определитель растений средней полосы европейской части СССР, — М., Учпедгиз, 1963.
- Пашкарь С. И. Физиологически активные соединения в селекционно-генетических процессах. — Кишинев, 1970.
- Чаховский А. А., Шапиро Д. К., Чекалинская И. И., Бобореко Е. З. Черноплодная рябина, облепиха и другие перспективные плодово-ягодные растения. — Минск, Ураджай, 1976.
- Chemistry and Biochemistry of Plant Pigments (Ed. by T. W. Goodwin). Academic Press. London and New York, 1965.
- Harborn I. B. Comparative biochemistry of the flavonoids. Academic Press. London and New York, 1967.
- Biosynthetic Pathways in Higher Plants (Ed. by I. B. Pridham anb T. Swain). Academic Press. London and New York, 1965.
- Riberau-Gayon P. Plant Phenolics. Edinburg, Oliver and Boyd, 1972.
И. А. Карабанов,
кандидат биологических наук, доцент
Редактор В. Д. Новик
Обложка художника В. В. Николаева
Художественный редактор В. В. Николаев
Технический редактор М. М. Соколовская
Корректор Б. Ф. Певзнер
ИБ № 818. Сдано в набор 12.09.80. Подписано к печати 16.03.81. Формат 84Х108 1/32. Бумага тип. № 3.
Гарнитура литературная Высокая печать. Усл. печ. л. 4.2. Усл. кр.-отт. 4,62. Уч.-изд. л. 5.16.
Тираж 90000 экз. Заказ 985. Цена 15 к. Издательство «Ураджай» Государственного комитета Белорусской
ССР по делам издательств, полиграфии и книжной торговли, 220600, Минск-4, пр. Машерова, 11.
Полиграфкомбинат им. Я. Коласа. Минск, Красная, 23.
Источник: http://plantlife.ru













